在化学学习过程中,会遇到两个数学形式完全一致的重要公式,分别是关于平衡常数的范特霍夫方程(公式1)和关于速率常数的阿伦尼乌斯公式(公式2)。

公式(1)定量描述了温度对化学平衡的影响:对于吸热反应,![]() ,升高温度时平衡常数增大,平衡向正反应方向移动;对于放热反应,
,升高温度时平衡常数增大,平衡向正反应方向移动;对于放热反应, ![]() ,升高温度时平衡常数减小,平衡向逆反应方向移动。换言之,升高温度,平衡向吸热方向移动;降低温度,平衡向放热方向移动。公式(2)定量描述了温度对反应速率的影响:升高温度时速率常数增大,反应速率升高;降低温度时速率常数减小,反应速率降低。并且,对于同一反应,低温区改变温度对速率的影响更显著;对于不同反应,当温度变化情况相同时,活化能较大的影响更显著。
,升高温度时平衡常数减小,平衡向逆反应方向移动。换言之,升高温度,平衡向吸热方向移动;降低温度,平衡向放热方向移动。公式(2)定量描述了温度对反应速率的影响:升高温度时速率常数增大,反应速率升高;降低温度时速率常数减小,反应速率降低。并且,对于同一反应,低温区改变温度对速率的影响更显著;对于不同反应,当温度变化情况相同时,活化能较大的影响更显著。
面对这两个重要公式,不禁自问:怎样记忆这两个公式?两个公式为何相似?
1 对比异同,记忆“形似”
记忆公式的方法有很多[1],对于这两个形式相似的公式,通过对比异同来增强记忆效果。
1.1 数学形式相同
公式(1)、(2)都是两个因式相乘得到乘积的形式,并且,其中关于温度变化的因式完全相同,乘积也都是一个比值的对数。从数学语言角度看两式相同之处:
(1)比较两个量的大小、比例关系时,通常用变化后的量减去或除以变化前的量。相应的,公式中,温度变化表示为“T2-T1”,平衡常数与速率常数变化分别表示为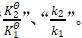
(2)对数函数的特征之一是真数为1时对数值为零,真数大于1时对数值为正数,真数小于1时对数值为负数。相应的,两个公式中,T2=T1时,等式右边函数值为零,对应左边真数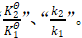 的值为1。对于公式(2),T2>T1时,函数值为正,对应真数k2>k1;T2<T1时,函数值为负,对应真数k2<k1。对于公式(1),若
的值为1。对于公式(2),T2>T1时,函数值为正,对应真数k2>k1;T2<T1时,函数值为负,对应真数k2<k1。对于公式(1),若![]() ,则T2>T1时,函数值为正,对应真数
,则T2>T1时,函数值为正,对应真数![]() ,而T2<T1时,函数值为负,对应真数
,而T2<T1时,函数值为负,对应真数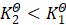 ;若
;若![]() ,则T2>T1时,函数值为负,对应真数
,则T2>T1时,函数值为负,对应真数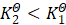 ,而时T2<T1,函数值为正,对应真数
,而时T2<T1,函数值为正,对应真数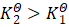 。两个公式都通过对数函数来表明
。两个公式都通过对数函数来表明![]() 、k为T的函数,T改变
、k为T的函数,T改变![]() 、k随之改变。
、k随之改变。
1.2 结构要素相异
公式(1)、(2)最明显的差异在非温度因式。从学科意义角度看两式结构要素相异之处:
(1)公式(1)中,非温度因式为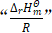 。要理解该因式存在的必然性,就要理解平衡常数K与反应焓变
。要理解该因式存在的必然性,就要理解平衡常数K与反应焓变![]() 的关系。平衡常数K仅是温度的函数,与
的关系。平衡常数K仅是温度的函数,与![]() 无必然联系,但是反应焓变代数值的正、负指示了吸、放热方向。而温度变化对化学平衡的影响结果由
无必然联系,但是反应焓变代数值的正、负指示了吸、放热方向。而温度变化对化学平衡的影响结果由![]() 代数值的正、负决定。因此,表示平衡常数的公式(1)中有一项包含
代数值的正、负决定。因此,表示平衡常数的公式(1)中有一项包含![]() 的因式。
的因式。
(2)公式(2)中,非温度因式为![]() 。要理解该因式存在的必然性,就要理解反应速率常数k与活化能Ea的关系。用速率方程定量描述反应速率的影响因素时,物质浓度(或压强)的影响在浓度项中体现,温度、催化剂的影响则体现在反应速率常数中。催化剂是通过改变活化能来影响反应速率的。因此,表示速率常数的公式(2)中有一项包含的因式。
。要理解该因式存在的必然性,就要理解反应速率常数k与活化能Ea的关系。用速率方程定量描述反应速率的影响因素时,物质浓度(或压强)的影响在浓度项中体现,温度、催化剂的影响则体现在反应速率常数中。催化剂是通过改变活化能来影响反应速率的。因此,表示速率常数的公式(2)中有一项包含的因式。
经过对比分析,学习者会发现,从形式和要素角度把握以上几点,便可准确记忆公式。
2 建构联系,理解“神似”
经验告诉我们,如果两个公式本身等价,形式相似便是自然。若两式中的差异要素对应等价,则公式(1)、(2)等价。从这个角度思考,需要分析![]() 与Ea、
与Ea、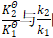 的联系。
的联系。
2.1 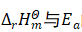 的联系
的联系
对于等压反应,正、逆反应的活化能之差等于反应焓变[2],即
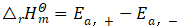 (3)
(3)
2.2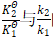 的联系
的联系
要使平衡常数与反应速率常数建立联系,可从平衡状态的特征进行分析。反应达到平衡时,从热力学角度来看,特征是各物质浓度不再变化,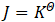 ;从动力学角度来看,特征是正、逆反应速率相等,v+=v-。
;从动力学角度来看,特征是正、逆反应速率相等,v+=v-。
为了便于理解,将研究对象设定为等压条件下的基元反应
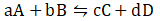
根据质量作用定律,有
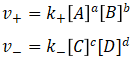
当反应达到平衡时,
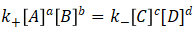
即,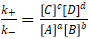 (4)
(4)
而平衡常数 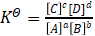 (5)
(5)
显然,(4)式与(5)式相等。
所以 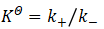 (6)
(6)
以上,通过对平衡状态的分析,推导而得的(6)式架起了联系热力学与动力学的桥梁。(3)式和(6)式分别体现了![]() 的联系、
的联系、![]() 的联系。
的联系。
2.3 两个公式的联系
由于(3)式、(6)式在形式上都包含正、逆两个反应,故分别考虑正反应、逆反应的速率常数,以公式(2)为起点进行推导:
正反应 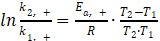 (7)
(7)
逆反应 ![]() (8)
(8)
(7)式减(8)式,得
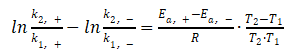
简单变形,得
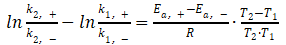
将(3)式、(6)式代入上式,得
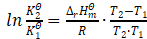
显然,公式(2)推导出了公式(1)。由此可见,公式(1)与公式(2)在设定条件下等价。
经过上述推导,学习者会发现两个公式不仅数学形式上相似,学科意义上也有必然联系,不仅形式上体现了数学语言简洁之美,内涵上也体现了热力学与动力学描述化学反应时的统一之美,哲学上更是体现了联系普遍性之美。需要说明的是,推导过程只限定在简化的特定条件下,从学科专业角度看,不全面[-4],但是有助于学习者走出机械记忆的泥沼,理解公式之间的联系,实现意义学习。
3 结语
公式是科学理论的数学量化形式,是一种认知模型。记忆并合理理解公式是学科知识学习的要求。这个学习过程能训练抽象思维、系统思维、定量分析等学科思维能力 []。剖析重要公式,为学生学习提供方法指导,有助于学生轻松、有序掌握学科知识,增强学习获得感。
参考文献
[1]殷开梁.理解和记忆物理化学公式的方法[J].化学教育(中英文),2020,41(4):99-102
[2]叶礼萍,罗渝然.化学反应速率常数与平衡常数的关系[J].大学化学,1987,4(2):53-56
[3]邹文樵.化学反应速率常数与平衡常数的关系[J].化学通报,1984,10(21):55-58
[4]唐隆健,王银伸.多维度深层理解并欣赏科学中的公式方程——以化学竞赛中几个经典公式方程为例[J].中学化学教学参考,2020,(01):37-40




