原发性肝癌是目前我国常见恶性肿瘤及肿瘤致死病因,主要包括肝细胞癌(HCC)、肝内胆管细胞癌(ICC)和cHCC-CCA混合型3种不同的病理学类型。中国属于全球肝癌发生率相对较高的区域。在中国每10万人中,会有8~10个以上患有肝癌,尤其是某些高危人群出现乙肝丙肝患者或者是高危人群中发生。目前我国肝癌发病率居恶性肿瘤第四位,死亡率居第二位。近年来,越来越多的临床医生采用腹腔镜技术来治疗原发性肝细胞癌,这不仅可以减少手术创伤,为外科医生提供清晰开放的手术领域,还可以促进术后快速康复,缩短住院时间,改善患者预后[1,2]。术中应用控制性低中央静脉压在肝切除中越来越受欢迎,但由于其潜在风险,其有效性和安全性仍有争议。基于上述情况,本研究通过比较术中出血量、切肝出血量、手术时间、肝门阻断时间、术中是否输血及术后肝肾功能、术后住院时间及并发症发生率等相关各项指标,探讨CLCVP在腹腔镜肝切除术中的有效性及安全性,为临床提供一定的参考。现报道如下:
资料与方法
1.一般资料
选取锦州医科大学附属第一医院2019年01月至2022年12月61例因肝癌行腹腔镜肝切除术的患者进行回顾性分析,经过锦州医科大学附属第一医院医学伦理委员会同意,病人或家属签署相关知情同意书,按照是否应用CLCVP将61例患者分为CLCVP组和对照组。31例应用控制性低中心静脉压(CLCVP组),21例纳入未控制的普通中心静脉压(对照组)。两组患者手术均为同一医疗组实施的腹腔镜下肝切除术,且术中使用Pringle法行肝门阻断。
2.方法
2.1麻醉与CLCVP方法
手术前一天进行术前访视,告知患者麻醉相关风险并签署同意书。61例患者均于术前禁食禁水,术前30min肌注安定10mg、阿托品0.5mg。一旦患者进入手术室,均开通静脉通路,连接监护仪进行心电图、脉搏血氧仪、潮汐末二氧化碳、动脉压力、CVP等生命体征监测。颈内静脉在麻醉诱导后由双通道导管插管,一个通道连接到传感器,以持续监测CVP。通过穿刺桡动脉来测量动脉压力。两组患者均留置导尿管,用于术中监测尿量。两组患者均采用静吸复合麻醉的方法进行全身麻醉方式。CLCVP组患者在麻醉诱导至肝脏病灶切除并止血完成前通过限制液体输入、采用反Trendelenburg体位(头高脚低)体位、静脉微量泵注硝酸甘油(0.5—5ug/kg/min),把中心静脉压控制在<5mmHg。切除病灶及止血完成后停止给药,快速输注晶体液和胶体液将CVP升高至正常水平范围。
2.2手术方法
所有患者均使用腹腔镜下肝切除术,手术均由同一医疗小组完成。术前可用3D成像等影像学方法来初步明确病变的部位、尺寸大小以及与周围血管关系。患者取仰卧位,术区常规消毒铺巾,术中体位采用反向Trendelenburg体位(头高脚低),关于患者双下肢是否需要分开、术者站位可根据自身经验、习惯决定。于脐下缘1.0cm纵切口,气腹针造气腹,满意后10mmTrocar入腹,进行腹腔镜探查,如若粘连不严重,无远处明显转移,能在腹腔镜下完成手术,继续明视下五孔法入腹,入腹后超声刀小心仔细分离,结合术前影像学检查及术中荧光腹腔镜ICG染色结果,明确切除部位,电凝钩标记预肝切除线,充分游离肝周韧带,根据需要切除部位、病灶与周围组织关系等充分游离肝脏周围的韧带,以便充分暴露切除操作区域,充分解剖显露第一肝门,于肝十二指肠韧带下方置入12号脑室引流管预以肝门阻断,肝门阻断时间每次阻断时间≤15~20min,间歇时间≥5min,可重复进行阻断。术中应用超声刀离断肝实质,较大的血管及胆管应用可吸收夹予以夹闭,必要时可使用切割闭合器,防止胆汁漏及出血。完整切除肿物后于左上腹切开长约5cm纵行切口,切口保护器保护切口,标本由切口处取出。肝创面反复电凝操作来彻底止血、纱布擦拭无胆汁样液体,创面处理完后还需要用盐水来再清洗创面,局部放置可吸收止血材料,根据实际情况留置腹腔引流管。
3. 观察指标
观察并记录两组手术时间、术中总出血量、切肝出血量、术中是否输血、肝门阻断时间,其中,术中出血量计算吸引器容量瓶中的血量(减去冲水量)、纱垫吸血量及创面敷料吸血量进行计算,断肝时出血量根据断肝前更换干净吸引瓶及纱布,断肝后吸引瓶容量加上纱条血量减冲水量去进行计算。手术时间记录从术者切皮开始至缝合结束。肝门阻断时间根据术中肝门阻断时间≤15~20min,间歇时间≥5min统计。观察并记录两组手术前及术后1d、3d、5d的谷丙转氨酶(ALT)、谷草转氨酶(AST)、血清肌酐(Scr)、血尿素氮(BUN)、β2微球蛋白(β2-MG)、α1微球蛋白(α1-MG)等指标水平、术后住院时间及并发症发生情况。
4.统计学方法
应用SPSS26.0统计软件进行分析。 计量资料用Shapiro-Wilk进行正态分布检验,符合正态分布的计量资料以均数±标准差(x̄±s)表示,2组比较采用独立样本t检验,非正态分布资料2组比较采用秩和检验(Mann-whitney U检验);计数资料比较采用卡方检验。P<0.05表示差异具有统计学意义。
结果
1. 两组患者一般基本资料比较
CLCVP组患者性别构成(男:女=22:9)、年龄(58.4±9.0)、身高(167.5±6.6)、体重(64.3±7.7)对比对照组性别构成(男:女=26:4)、年龄(60.4±8.7)、身高(167.8±6.4)、体重(67.7±8.3),差别均无统计学意义(P>0.05),见表1。
表1 一般基本资料对比
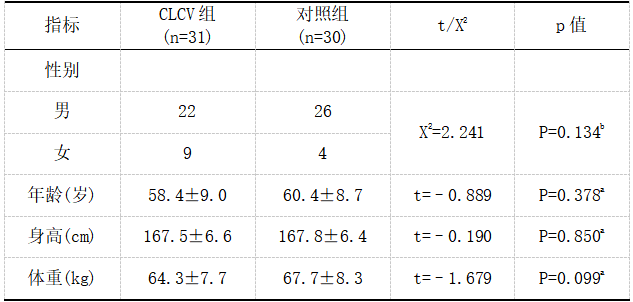
注:a采用独立样本t检验,b采用卡方检验。
2. 两组患者术前肝肾功能比较
CLCVP组31例患者,对照组30例患者,两组患者术前肝肾功能对比,CLCVP组ALT(30.6±15.7)、AST(26.0±10.0)、BUN(5.4±1.5)、SCr(63.2±13.9)、β2-MG(2.0±1.0)、α1-MG(20.0±5.7),对照组ALT(37.1±17.0)、AST(28.6±10.7)、BUN(5.1±1.3)、SCr(63.5±10.0)、β2-MG(2.2±0.6)、α1-MG(20.2±4.0),两组比较差异无统计学意义(P>0.05),见表2。
表2 术前肝肾功能对比
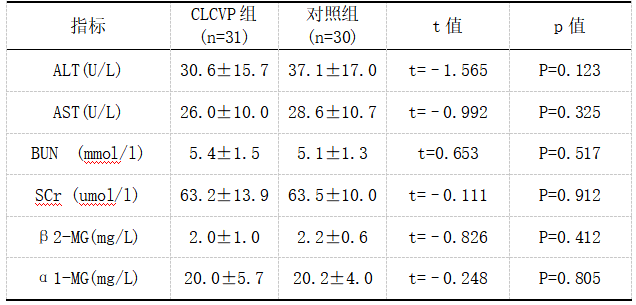
注:P>0.05无统计学意义。
3. 两组患者术中指标比较
对两组患者切肝出血量、手术时间、肝门阻断时间行正态性检验,计量资料为正态性分布,采用独立样本t检验,计量资料用均数±标准差表示。CLCVP组切肝出血量(76.9±15.6)、手术时间(179.4±50.7)、肝门阻断时间(24.1±6.9)对比对照组切肝出血量(116.7±50.2)、手术时间(239.6±56.1)、肝门阻断时间(30.0±7.4),两组比较差异具有统计学意义(P<0.05)。患者术中总出血量行正态性检验,计量资料呈偏态分布,所以采用秩和检验进行统计学分析,用中位数(Q1,Q3)表示,CLCVP组总出血量120(100,183),对照组225(200,400),CLCVP组以上各项指标均低于对照组,差异有统计学意义(P<0.05)。两组患者按照术中是否输血采用卡方检验,CLCVP组输血例数为3例,占比9.6%,对照组输血例数为4例,占比13.3%,两组比较差异无统计学意义(P>0.05)。见表3。
表3 术中指标对比
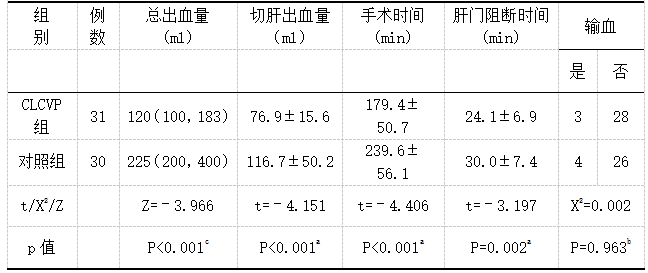
注:a采用独立样本t检验,b采用卡方检验,c采用秩和检验;P<0.05有统计学意义,P>0.05无统计学意义。
4. 两组患者术后住院时间及并发症比较
统计分析两组患者术后住院时间,CLCVP组术后住院时间为(11.6±3.7),对照组术后住院时间为(12.2±3.1),CLCVP组术后住院时间略短于对照组,但差异无统计学意义(P>0.05)。两组患者发生并发症情况,CLCVP组4例,对照组6例,分别占比12.9%和20%,但两组比较无统计学意义(P>0.05)。见表4。
表4 术后住院时间及并发症对比
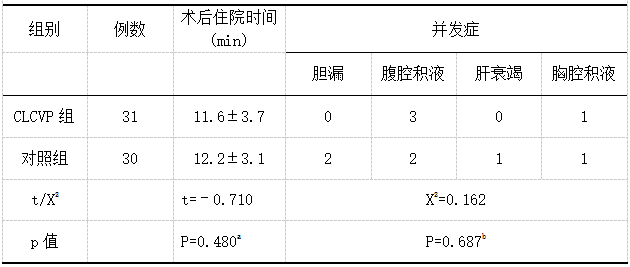
注:a采用独立样本t检验,b采用卡方检验。
5. 两组患者术后1d、3d、5d肝肾功能比较
对患者术后1d、3d、5d肝肾功能的各项指标进行正态性分析,计量资料符合正态性分布,行独立样本t检验。CLCVP组ALT、AST术后1d、3d、5d分别为(191.7±108.5),(177.2±103.4)、(122.9±74.0),(72.0±34.6)、(54.8±28.4),(30.1±8.5)对比对照组,两组术后1d、3d、5d的肾功能指标对比对照组,两组比较差异均无统计学意义(P>0.05)。见表5.6。
表5 两组患者术后肝功能比较
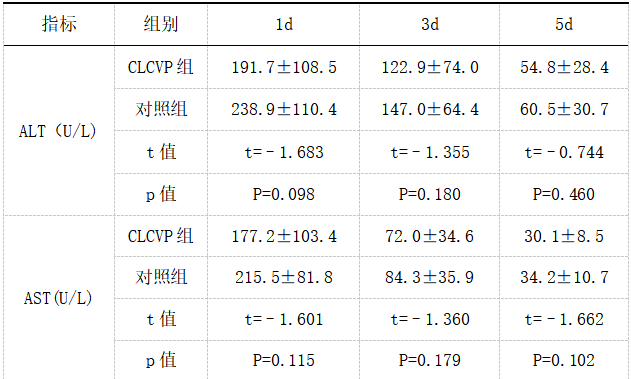
注:术后1d、3d、5d分别为手术后第1天、第3天、第5天。
表6 两组患者术后肾功能比较
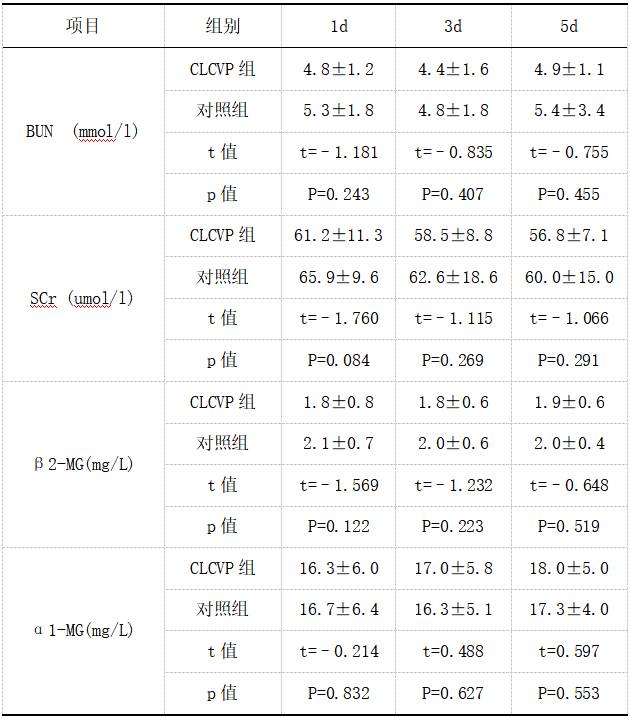
注:1d、3d、5d分别表示为手术后第1天、第3天、第5天。
讨论
肝脏的血流供应丰富,成人肝脏每分钟血流量可达1500~2000ml,肝脏内又含有数量丰富的血窦,行肝脏切除术出血的控制就成为了极其关键的一点,相关研究表明肝切除术后的发病率和死亡率与术中过度失血和输血有关[3-5]。因此,找到更加及时有效控制出血的方法对于接受肝切除术的良性和恶性肝病患者具有重要的临床意义和实用价值。之前的相关研究表明,肝切除术中的出血,与中心静脉压存在一定关联[6]。刘玉勇等[7]在对46例接受肝切除的患者研究中,将CVP保持在2-4 mmHg,MBP保持在60 mmHg以上,结果显示低CVP可以显著减少肝切除期间的出血量。因此术中控制性低中央静脉压(CLCVP)在肝切除术中就越来越受临床医生的青睐。本研究中所采用的是限制液体输入、使用微量硝酸甘油静脉泵注、体位改变等方法达到低中心静脉压。本研究中CLCVP组患者总出血量和切肝出血量与对照组相比较,两者明显低于对照组。同时一项研究表明,LCVP不仅可以使腔静脉及其分支塌陷,有利于游离肝脏后部和主要肝脏静脉,还可以缩短手术时间[8],分析其原因可能为由于低中心静脉压导致出血量的减少间而导致手术视野的的清晰及止血的时间缩短,大静脉的塌陷间而导致游离肝脏的时间缩短,所以总体来看缩短了手术时间。因此本研究分析认为术中应用控制性中心静脉压可以显著减少术中出血量及手术时间。
虽然CLCVP在几项评估肝切除和移植的研究中被证明在减少手术性失血方面是安全和有效的[9-12],它的广泛应用仍然存在一定的争议。有人担心,在肝脏切除的LCVP阶段,体内器官灌注不足可能导致重要脏器损伤。具体而言,相对低血压和潜在低灌注可能对肝肾等重要脏器功能造成影响,进而导致患者预后差,术后恢复慢,出现严重并发症甚至可以导致肝衰竭甚至死亡[12]发病率和死亡率分别为1.2%-32%[13]和1.6%-1.8%[14,15] 然而日本学者加藤正人等人[16] 研究结果表明术后1、3和5d的BUN和肌酐值没有显著的差异。国外学者Elisabetta Moggia等人[17]在对大样本临床数据分析中也证实了在低中心静脉压下,不会对患者的肝肾功能产生损伤。这与本研究结果大致相符合,在本研究中,CLCVP组的术后1d、3d、5d肝肾功能的大部分指标均低于对照组,尽管对照组的指标相对高于CLCVP组,但其差异并不具有统计学意义。
胸腔积液、胆漏、腹水、肝衰竭、空气栓塞等是腹腔镜肝脏手术术后常见的并发症。其中空气栓塞是应该值得关注的并发症之一。有相关研究表明,腹腔镜手术在气腹状态下,如若术中肝静脉等血管出血,气腹中的CO2通过血管破裂的部位进入到机体,是造成空气栓塞的重要原因之一,并且有研究称患者采用Trendelenburg体位(头低足高)也可能会导致空气栓塞,本研究中采用的是反Trendelenburg体位(头高足低),既能避免出现空气栓塞的意外,并且术中的视野也能得到充分显现,在本研究中两组患者均未发现出现空气栓塞的并发症。这与最新的两项研究[18,19]结果一致,应用CLCVP是安全的,不会增加空气栓塞的发生率。在本研究中61例患者术中出现腹水5例,给予对症治疗,注射人血白蛋白后好转。出现胸腔积液2例,给予对症治疗后好转,出现胆漏2例,给予保持通畅引流,加强营养促进胆漏愈合的方案后好转,出现肝衰竭1例,采用综合支持和对症治疗后,肝功能逐渐恢复。在本研究中,两组的并发症发生率无统计学差异,这与李志和王伟东[9,10]的研究结果一致。本研究中两组患者术后住院时间,CLCVP组略短于对照组,但在统计学上无明显差异。有研究称术后住院时间的独立影响因素与手术有关,与外科医生也有关,外科医生在影响住院时间方面发挥着关键作用[20]。还有相关研究表示采用CLCVP的患者,术后住院时间更短,这可能与减少术中出血量,缩短了手术时间,从而降低了对身体的打击有关,这与本研究结果不太一致。笔者认为患者术后住院时间受多方面因素影响,比如患者身体状况,基础疾病,年龄,术中情况等,这些都可能会造成术后住院时间的延长或缩短。因为未来可能需要更大的样本量来进一步论证。
综上所述,肝癌行腹腔镜肝叶切除术治疗术中应用控制性低中静脉压技术,可以降低术中出血量,缩短肝门阻断时间和手术时间,不会对肝脏肾脏等重要脏器造成损伤,并且不会增加空气栓塞等并发症的风险,因次CLCVP具有一定安全性和有效性。
参考文献
[1]Yin Z, Fan X, Ye H, Yin D, Wang J. Short- and long-term outcomes after laparoscopic and open hepatectomy for hepatocellular carcinoma: a global systematic review and meta-analysis. Ann Surg Oncol. 2013;20:1203–1215.
[2]Aldrighetti L, Belli G, Boni L, Cillo U, Ettorre G, De Carlis L, Pinna A, Casciola L, Calise F. Italian experience in minimally invasive liver surgery: a national survey. Updates Surg. 2015;67:129–140.
[3]Yin Z, Fan X, Ye H, Yin D, Wang J. Short- and long-term outcomes after laparoscopic and open hepatectomy for hepatocellular carcinoma: a global systematic review and meta-analysis. Ann Surg Oncol. 2013;20:1203–1215.
[4]Aldrighetti L, Belli G, Boni L, Cillo U, Ettorre G, De Carlis L, Pinna A, Casciola L, Calise F. Italian experience in minimally invasive liver surgery: a national survey. Updates Surg. 2015;67:129–140.
[5]Otsubo T. Control of the inflow and outflow system during liver resection. J Hepatobiliary Pancreat Sci. 2012;19:15-18.
[6]Nagao T, Inoue S, Goto S, Mizuta T, Omori Y, Kawano N, Morioka Y. Hepatic resection for hepatocellular carcinoma. Clinical features and long-term prognosis. Ann Surg. 1987;205:33-40.
[7]Yanaga K, Kanematsu T, Takenaka K, Matsumata T, Yoshida Y, Sugimachi K. Hepatic resection for hepatocellular carcinoma in elderly patients. Am J Surg. 1988;155:238-241.
[8]Ryckx A, Christiaens C, Clarysse M, et al. Central Venous Pressure Drop After Hypovolemic Phlebotomy is a Strong Independent Predictor of Intraoperative Blood Loss During Liver Resection. Ann Surg Oncol 2017;24:1367-75. 10.1245/s10434-016-5737-7
[9]Liu Y, Cai M, Duan S, Peng X, Lai Y, Li Y. Effect of controlled low central venous pressure on renal function in major liver resection. Chin-Germ J Clin Oncol. 2008;7:7-9.
[10]TIMOTHY M,PAWLIK M D,CHARLES Ret al.Advances in the surgical management ofliver malignancies[J].Cancer J,2004,10( 1):74-87.
[11]Li Z, Sun YM, Wu FX, Yang LQ, Lu ZJ, Yu WF. Controlled low central venous pressure reduces blood loss and transfusion requirements in hepatectomy. World J Gastroenterol. 2014 Jan 7;20(1):303-9.
[12]Wang Wei-Dong,Liang Li-Jian,Huang Xiong-Qing,Yin Xiao-Yu. Low central venous pressure reduces blood loss in hepatectomy.[J]. World journal of gastroenterology,2006,12(6).
[13]M. Rees, G. Plant, J. Wells, S. BygraveOne hundred and fifty hepatic resections: evolution of technique towards bloodless surgeryBr J Surg, 83 (1996), pp. 1526-1529.
[14]Z.Y. Feng, X. Xu, S.M. Zhu, B. Bein, S.S. ZhengEffects of low central venous pressure during preanhepatic phase on blood loss and liver and renal function in liver transplantationWorld J Surg, 34 (2010), pp. 1864-1873.
[15]Rahbari NN, Garden OJ, Padbury R, Brooke-Smith M, Crawford M, Adam R, Koch M, Makuuchi M, Dematteo RP, Christophi C, Banting S, Usatoff V, Nagino M, Maddern G, Hugh TJ, Vauthey JN, Greig P, Rees M, Yokoyama Y, Fan ST, Nimura Y, Figueras J, Capussotti L, Büchler MW, Weitz J. Posthepatectomy liver failure: a definition and grading by the international study group of liver surgery (ISGLS) Surgery. 2011;149:713–724.
[16]Hyder O, Pulitano C, Firoozmand A, Dodson R, Wolfgang CL, Choti MA, Aldrighetti L, Pawlik TM. A risk model to predict 90-day mortality among patients undergoing hepatic resection. J Am Coll Surg. 2013;216:1049–1056.
[17]Mullen JT, Ribero D, Reddy SK, Donadon M, Zorzi D, Gautam S, Abdalla EK, Curley SA, Capussotti L, Clary BM, Vauthey JN. Hepatic insufficiency and mortality in 1,059 noncirrhotic patients undergoing major hepatectomy. J Am Coll Surg. 2007;204:854–862.
[18]Kato M, Kubota K, Kita J, Shimoda M, Rokkaku K, Sawada T. Effect of infra-hepatic inferior vena cava clamping on bleeding during hepatic dissection: a prospective, randomized, controlled study. World J Surg. 2008;32:1082-1087.
[19]Moggia E, Rouse B, Simillis C, Li T, Vaughan J, Davidson BR, Gurusamy KS. Methods to decrease blood loss during liver resection: a network meta-analysis. Cochrane Database Syst Rev. 2016 Oct 31;10(10):CD010683.
[20]陈羽青,彭书崚,林少漫,刘嘉羿,张磊,洪玉.控制性低中心静脉压用于ERAS腹腔镜肝癌切除术的价值[J].中华麻醉学杂志,2020,40(03):305-308.
[21]史惠中,熊奇如,夏俊,张超,贾冉,俞广进,戴伟.控制性低中心静脉压在原发性肝癌伴肝炎后肝硬化患者腹腔镜肝切除中的应用[J].中国普通外科杂志,2020,29(01):27-34.
[22]Hsia CY, Chau GY, King KL, Loong CC, Lui WY, Wu CW. Factors for prolonged length of stay after elective hepatectomy for hepatocellular carcinoma. The surgeon's role in the managed care era. Hepatogastroenterology. 2003 May-Jun;50(51):798-804.



