伴随我国药品生产质量管理水平的提升,越来越多的人开始关注无菌药品生产质量,为强化药品生产过程中的质量管理,有必要加强注射剂微生物污染水平检测,并确定相应工艺时限,以保证生产产品达到安全指标,避免影响人体健康,利于强化药品市场规范化管理。但是,如何进行注射剂微生物污染水平测试及工艺时限确定成为值得探讨的话题。基于此,本文以某试验研究为例,总结相关试验测试方法与结果,加强工艺时限的确定分析,这对于强化药品生产质量管理具有重要的现实意义。
1注射剂微生物污染水平测试的重要性
实际上,无菌产品生产过程中,生产企业需要注意无菌保证,防止出现微生物污染情况的发生,确保注射剂生产质量要求,达到安全性指标。然而,无菌检查存在一定局限性,无菌产品质量可能受到灭菌设备、灭菌介质、工艺程序以及生产环境等方面的影响,容易出现无菌检查难以预料的结果。理论上,微生物污染率越低,若是取样量相同,可能将无菌产品判定为合格的概率更高;如果微生物污染率条件相同,取样量越大,根据试验结果判断产品质量情况,其可信度将会更高。然而,针对污染率极低的生产药品,取样量加大也无济于事,其结果并不可信,而且还容易增加试验时的微生物污染概率,影响实际无菌试验结果的准确性。所以,有必要加强无菌药品生产各个工序环节的研究,加强注射剂微生物污染水平的测试,为后续工艺时限确定提供参考,进一步提高无菌药品生产质量。
2注射剂微生物污染水平测试及工艺时限确定
2.1试验准备
本次试验模拟生产品种:某品牌注射液,规格:5ml,生产批量:12万支,灌装时间:8h,灭菌:6柜次。
2.2试验方案
2.2.1制定取样计划
首先,本次试验过程中,选择的小容量注射剂,其注射剂为最终灭菌制剂,生产工艺流程包括称量、浓配、超滤、稀配定容、过滤、除菌过滤、灌装、灭菌检漏等环节。试验计划如下:模拟灌装时间确定为8h,要求严格按照注射液工艺进行生产,并加强微生物限度检查以及周围环境监测,监测内容包括温度监测、湿度监测、风速监测等内容。
其次,具体取样计划如表1所示,样品1为稀配罐内的稀配液,按照200ml/次、间隔1小时的频率进行取样,用于检测微生物数量;样品2为除菌过滤之前的药液,按照200ml/次、间隔1小时的频率进行取样;样品3为除菌过滤后的药液,按照40支/次、间隔1小时的频率进行取样;样品4和样品5分别为灭菌前药液和待灭菌放置1小时药液,均取第一锅和最后一锅进行微生物数量检测。
表1 取样点及取样频次信息表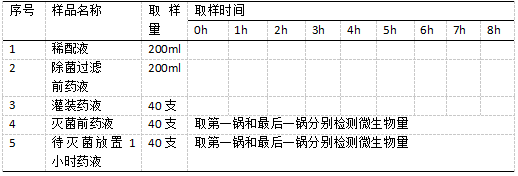 2.2.2检验方法
2.2.2检验方法
采用薄膜过滤法进行药液的微生物限度检查。取滤膜孔径0.45μm,直径为75mm的一次性全封闭薄膜过滤器(北京牛牛基因技术有限公司,滤器类型:NS01-75D1),将过滤器逐一插放在滤液槽座上,将其塑胶软管装入集菌仪的蠕动泵的管槽内,注意定位准确,软管走势顺畅。其进液软管的双芯针头插入供试液容器的塞上,开启集菌仪,将供试液容器倒置,使药液均匀通过滤器,滤净。打开过滤器菌面朝上贴于营养琼脂培养基和玫瑰红钠琼脂培养基平板上培养。每种培养基制备一张滤膜。细菌培养3天,霉菌、酵母菌培养5天,逐日观察菌落生长情况,点计菌落数,必要时,可适当延长培养时间至7天进行菌落计数并报告。
2.3试验结果分析
2.3.1微生物污染水平检测结果
如表2所示,为样品1~3微生物污染水平检测结果,通过每隔一小时进行取样检查,最终检查出的微生物限度均不相同。以样品1为例,在微生物水平检测过程中,前几个小时均无微生物检出,直到第5个小时检测出微生物,数量约8cfu/100ml,而且伴随时间的不断增长,检测出的微生物含量越多,第8个小时检出微生物数量达到369cfu/100ml,最终经过验证,其定容后药液载菌量在过滤器的除菌能力范围内,8小时可作为样品1微生物污染控制限度的时间点。此外,样品2和样品3的微生物污染水平检测结果表明,除菌过滤前药液和灌装药液微生物污染控制限度时间点均为8h,但是,可将7小时作为除菌过滤前药液预留的安全时间,6小时作为灌装药液预留的安全时间,满足内部控制时限要求。
表2 样品1~3微生物污染水平检测结果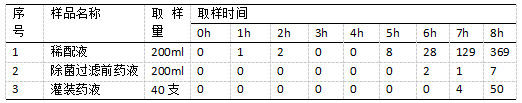 如表3所示,为样品4~5微生物污染水平检测结果,样品4第一锅的未检测出微生物数量,最后一锅检测出的微生物数量约37cfu/1 00ml,符合本次100 cfu/100ml的灭菌工艺生产要求;样品5取第一锅和最后一锅待灭菌时间最长的药液,并放置1h后进行测量,虽然第一锅微生物数量仅为3 cfu/1 00ml,但是最后第一锅检测出微生物数量约118cfu/100ml,明显超出100cfu/100ml的微生物数量控制要求。
如表3所示,为样品4~5微生物污染水平检测结果,样品4第一锅的未检测出微生物数量,最后一锅检测出的微生物数量约37cfu/1 00ml,符合本次100 cfu/100ml的灭菌工艺生产要求;样品5取第一锅和最后一锅待灭菌时间最长的药液,并放置1h后进行测量,虽然第一锅微生物数量仅为3 cfu/1 00ml,但是最后第一锅检测出微生物数量约118cfu/100ml,明显超出100cfu/100ml的微生物数量控制要求。
表3 样品4~5微生物污染水平检测结果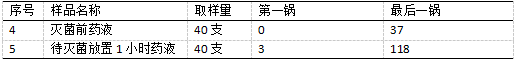 2.3.2工艺时限确定
2.3.2工艺时限确定
如表4所示,为上述工序环节的微生物污染控制限度的时间点和内部控制时限汇总表,由表中数据可确定工艺时限:第一,结合灭菌工序的微生物数量检测结果,可将9h可以作为稀配至灭菌污染控制限度的时间点,7h则作为内部控制时限要求。第二,从稀配定容到灌装结束,工艺时限控制为6h;灌装到灭菌工序结束的时限则为7h,其中每次最长待灭菌时限为3小时。
表4 污染控制限度的时间点和内部控制时限汇总表 3结语
3结语
综上所述,本文基于无菌药品生产质量问题,研究了一种注射剂微生物污染水平测试方法,主要将根据试验方法,模拟模拟灌装的时间为8小时,样品1~样品3每隔1小时取样检测一次微生物量,样品4~样品5取第一锅、最后一锅分别检测微生物量。试验检测结果显示,不同样品的灌装药液污染控制限度的时间点和内部控制时限要求略有不同,最终确定从稀配定容到灌装结束位置,工艺时限为6小时;灌装工序开始到灭菌结束期间,工艺时限为7小时,有效确定了工艺时限,为有无菌药品生产质量控制提供了指导与借鉴。
参考文献
[1]邹意琼,罗娟,邹光莉.关于注射剂中添加抑菌剂的思考[J].科技视界,2020,(12):176-177.
[2]谢纪珍,冯巧巧,刘军田,周冲,马铃铃.化学药品注射剂灭菌工艺选择及工艺验证常见问题探讨[J].药学研究,2018,37(06):370-372.
[3]许真玉.化学药品注射剂湿热灭菌工艺的研究与验证[J].现代药物与临床,2009,24(05):301-305.
[4]李永亮,张宏飞.注射剂无菌安全存在的问题及对策思考[J].中国实用医药,2008,(01):155-157.




