癌症是严重危害人类健康的全球性问题,居全球30~69岁居民死因前2位,造成巨大社会和经济负担[1]。2020年,我国胃癌新发病例47.9万例,死亡37.4万例,居我国癌症发病率和死亡率第3位[2],确诊时80%晚期,5年生存率仅28%左右,化疗为既往标准治疗,可延长生存,但中位生存仅10.5~11.6个月[3-4]。免疫检查点抑制剂(ICIs)已改变晚期胃癌治疗格局,CheckMate 649研究[5]为免疫治疗在晚期胃癌中应用奠定了重要地位,RATIONALE 305研究[6]结果刷新了免疫治疗联合化疗治疗晚期胃/胃食管结合部腺癌(GC/GJC)生存纪录,ORIENT-16研究[7]为信迪利单抗联合化疗治疗晚期胃癌提供了理论基础。为探索晚期GC/GJC更加有效治疗方式,本研究应用信迪利单抗联合奥沙利铂和替吉奥(SOX)进行一线治疗,观察临床疗效和安全性,现将结果报告如下。
1资料与方法
1.1一般资料 选取兴化市中医院2020年12月至2023年4月63例初治晚期GC/GJC患者,开展前瞻性研究,通过随机数字表法分为观察组(32例)与对照组(31例)。纳入标准:⑴经病理学确诊GC/GJC,TNM分期(第八版)Ⅳ期;⑵年龄≥18周岁;⑶ECOG评分0或1分;⑷影像学至少有一个可测量病灶;⑸预计生存期≥3个月;⑹患者对临床研究知情并签署同意书。排除标准:⑴合并其他恶性肿瘤;⑵HER-2阳性者;⑶自身免疫性疾病处于活动期。两组临床资料比较,差异无统计学意义(P>0.05),见表1。
表1 两组晚期GC/GJC患者基线资料比较 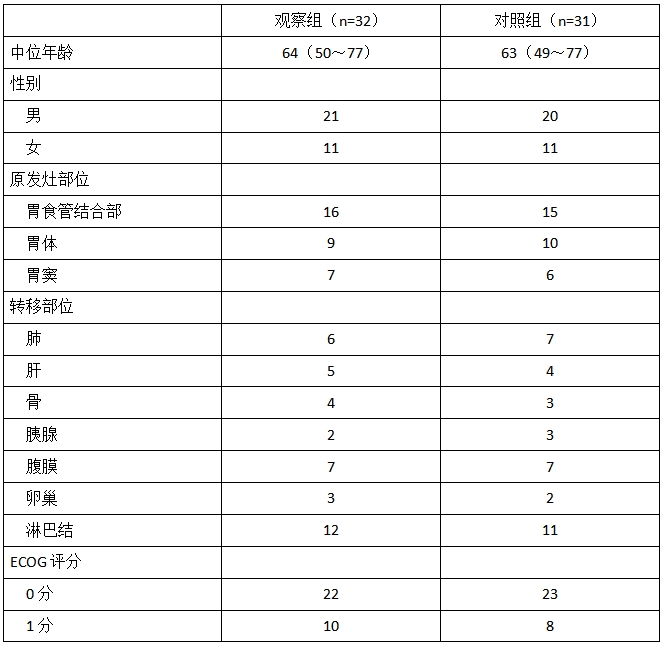
1.2治疗方案 对照组,SOX方案:奥沙利铂130mg/m2(江苏恒瑞医药股份有限公司,国药准字H20213312),静滴,d1。替吉奥(齐鲁制药有限公司,国药准字H20100150)(规格20 mg/片,按替加氟计):体表面积≥1.5m2,120mg/d; 体表面积<1.25m2,80mg/d;其余,100mg/d;口服14d,早晚分服。观察组,SOX方案联合信迪利单抗[信达生物制药(苏州)有限公司,国药准字S20180016]:信迪利单抗200mg,静滴,d1。均21d为1个疗程,共持续6个周期。
1.3疗效评价 参考实体肿瘤疗效评价标准1.1(RECIST1.1)分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),ORR(客观缓解率)=CR+PR,DCR(疾病控制率)=CR+PR+SD。无进展生存期(PFS)为从开始接受治疗,到观察到PD或者因任何原因死亡的时间。总生存期(OS)是指从随机化开始至因任何原因死亡的时间。按照不良反应分级标准(CTCAE)评估治疗相关的不良事件。每2个疗程进行疗效评价及安全性评估。
1.4随访 末次随访时间截止2024年04月,采用门诊、住院或电话的方式进行随访。
1.5统计学分析 采用SP21.0版对研究数据进行分析统计。计量资料经方差齐性及正态性检验,确认具备方差齐性且近似服从正态分布行t检验,计数资料比较采用卡方检验。生存分析采用运用Kaplan-Meler法进行log-rank检验。以p<0.05为差异有统计学意义。
2结果
2.1近期疗效 63例患者均完成6个周期治疗,均可疗效评价。观察组CR2例、PR17例、SD7例和PD6例,ORR和DCR为59.38%和81.25%。对照组CR0例、PR13例、SD7例和PD11例,ORR和DCR为41.94%和64.52%。两组ORR和DCR比较,差异均有统计学意义(p<0.05)。
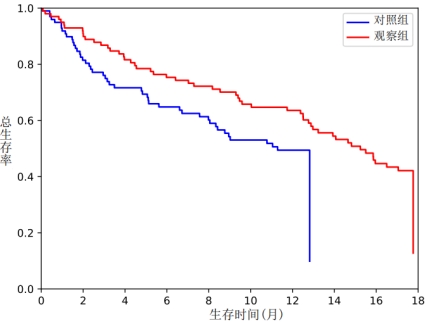
2.2远期疗效 全组随访12~18个月,中位PFS和OS:观察组7.6个月和15.1个月;对照组5.5个月和12.1个月。两组中位PFS和OS比较,差异无统计学意义(p>0.05)。
见图1和图2
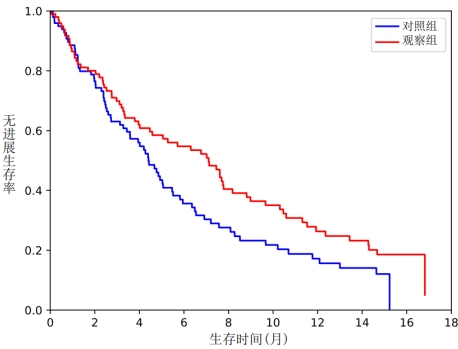
图2
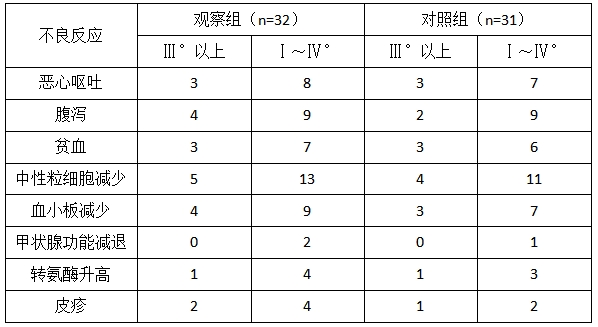
2.3不良反应 两组主要不良反应有恶心呕吐、腹泻、贫血、中性粒细胞减少、血小板减少、甲状腺功能减退、转氨酶升高、皮疹,考虑由化疗药物所致,Ⅲ°以上发生率低,无免疫相关严重不良反应。两组不良反应比较,差异无统计学意义(p>0.05)。
表2 两组晚期GC/GJC患者不良反应比较
 3讨论
3讨论
晚期GC/GJC预后较差,传统化疗疗效不理想。人体免疫系统具有双重作用,主要抑制肿瘤生长;其次通过癌症免疫编辑的动态过程来重塑免疫原性,促进肿瘤发展。包括三个阶段:消除、平衡和逃避。逃避阶段,肿瘤细胞过表达PD-L1和PD-L2,与T淋巴细胞上PD-1受体结合,引起T淋巴细胞耗竭,导致免疫抑制,恶性肿瘤不可控生长[8]。GC/GJC异质性强,免疫原性弱,肿瘤微环境成为抗肿瘤免疫细胞敌对环境。免疫逃逸和肿瘤微环境复杂,基于肿瘤逃逸机制研发的肿瘤免疫疗法,“操纵”免疫系统,重新激活抗肿瘤免疫反应,克服免疫逃逸。研究表明,人体T细胞和胃癌组织中存在PD-L1和PD- 1过表达,表达上调为ICIs治疗提供分子基础[9]。信迪利单抗是重组全人源化IgG4单克隆抗体,通过结合PD- 1,阻断PD- 1与PD- L1和PD- L2结合,解除免疫抑制,激活T细胞功能,增强T细胞杀伤肿瘤细胞能力。化疗药物引起肿瘤细胞免疫性死亡,与PD-1抑制剂联用起协同促进作用。SOX-GC研究推荐非肠型胃癌首选SOX。CheckMate-649、ATTRACTION-4研究,ORR提高,PFS和OS延长,为改写胃癌指南提供了有力证据[5,10]。ORIENT-16研究[7]结果,明显改善全人群OS(15.2个月vs12.3个月)、中位PFS(7.1个月vs5.7个月)和ORR(58.2%vs48.4%),信迪利单抗联合XELOX方案成为CSCO胃癌指南2022 版HER-2阴性晚期胃癌一线治疗方案。
本研究显示,SOX联合或不联合信迪利单抗一线治疗晚期GC/GJC,两组ORR:59.38%vs41.94%,DCR:81.25%vs64.52%,差异均有统计学意义,显示观察组疾病控制良好,具有显著的优势,提示更好治疗效果。虽然两组中位PFS:7.6个月vs5.5个月,中位OS:15.1个月vs. 12.1个月,差异无统计学意义,可能与随访时间短及入组样本量偏小有关,但观察组有延长趋势,值得进一步研究。两组治疗安全性良好,不良反应主要有消化道反应和骨髓抑制,均不严重,程度较轻,耐受性良好。
综上所述,信迪利单抗联合SOX一线治疗晚期GC/GJC具有良好的临床疗效和安全性,疾病控制满意,患者生存质量改善,且显示出生存趋势延长,但因本研究样本量偏小,需要今后进行大样本量的临床研究进一步证实。
参考文献
[1]Chen S,Cao Z,Prettner K,et al.Estimates and projections of the global economic cost of 29 cancers in 204countries and territories from 2020 to 2050[J].JAMA Oncol,2023,9(4):465-472.
[2]Cao W,Chen H,Yu Y,et al.Changing profiles of cancer burden worldwide and in China:a secondary analysis of the global cancer statistics 2020[J].Chin Med J,2021,134(7):783-791.
[3][美]Robert CB,Carlo MC,William NH,et al主编.Holland-Frei癌症医学[M].赫捷,王红阳,石远凯主译;北京:人民卫生出版社,2021:995-1005.
[4][美]Samir NK,Olivier R,Roland TS主编.斯基尔癌症治疗手册[M].于世英主译;北京:科学出版社,2020:156-165.
[5]Markus H,Moehler KS, Marcelo G,et al.First-line (1L) nivolumab (NIVO) plus chemotherapy (chemo) versus chemo in advanced gastric cancer/gastroesophageal junction cancer/esophageal adenocarcinoma(GC/GEJC/EAC):Expanded efficacy and safety data from CheckMate 649[J].J Clin Oncol,2021,39(suppl15):abstr 4002.
[6]Moehler MH,Kato K,Arkenau HT,et al.Rationale 305: Phase 3 study of tislelizumab + chemotherapy vs placebo + chemotherapy as first-line treatment of advanced gastric or gastroesophageal junction adenocarcinoma[J].J Clin Oncol,2023,41(suppl 4):abstr 286.
[7]Xu JM,Jiang H,Pan Y,et al.Sintilimab plus chemotherapy (chemo) versus chemo as first-line treatment for advanced gastric or gastroesophageal junction(G/GEJ) adenocarcinoma(ORIENT-16):First results of a randomized, double-blind, phase Ⅲ study[J].Annal of Oncol,2021,32(suppl 5):S1283-S1346.
[8][美]Aung N,Joud H主编.免疫治疗[M].苏春霞主译;北京:科学出版社,2019:9-25.
[9]吴小亮,梁文华,张荣欣.肿瘤靶向治疗及免疫治疗进展[M].北京:科学出版社,2020:30-52.
[10]Kang YK,Chen LT,Ryu MH,et al.Nivolumab plus chemotherapy versus placebo plus chemotherapy in patients with HER2-negative,untreated,unresectable advanced or recurrent gastric or gastro-oesophageal junction cancer(ATTRACTION-4):A randomised,multicentre,double-blind,placebo-controlled,phase 3 trial[J].Lancet Oncol,2022,23(2):234-247.
作者:潘永军,肿瘤科主任,副主任医师。