近年来,结肠息肉的发病率在逐年上升。据相关文献结果显示:结直肠息肉的发病率约为2%—20%,结肠息肉的分类多而复杂,主要分为非肿瘤性病变和肿瘤性病变。非肿瘤性息肉恶变率低,而肿瘤性息肉恶变率高。该病的发病机制一般认为与炎症、遗传、基因突变等因素有密切关系。但多数患有结肠息肉的病人在早期无明显的症状,往往在进行肠镜检查时才发现。后期随着疾病的进展患者会逐渐出现腹痛、腹泻、肠道出血、肠梗阻等一系列的症状,部分患者的结肠息肉会有癌变的机率[1]。对于此病往往手术治疗为主,根据息肉的大小数目、病理性质和并发症,决定适合患者的治疗方案,但由于部分患者的息肉位置比较特殊,在内镜的处理下依旧十分困难,因此需要更加精准的标记定位方式来达到最初的治疗目的。鉴于此,本次实验选取了我院进行腹腔镜结肠息肉手术的患者共计86例采用不同的手术方案进行结肠息肉的切除,现将相关结果报道如下。
1资料与方法
1.1一般资料
选取我院在2019年10月—2022年12月收治的结肠息肉需在腹腔镜下行切除术的患者共计86例,按照随机数表的方法分为对照组和观察组各43例。对照组男性患者23例,女性患者20例,年龄28—64岁,平均年龄(42.45±4.66)岁,息肉情况:息肉最长直径3.8cm,最短直径0.6cm,平均直径(1.83±0.45)cm,息肉位于升结肠16例,肝曲5例,回盲部8例,横结肠6例,降结肠4例,乙状结肠2例,直肠上端2例;观察组男性患者22例,女性患者21例,年龄27—65岁,平均年龄(46.36±3.67)岁,息肉情况:息肉最长直径3.4cm,最短直径0.5cm,平均直径(1.36±0.64)cm,息肉位于升结肠14例,肝曲6例,回盲部7例,横结肠7例,降结肠4例,乙状结肠3例,直肠上端2例。两组患者的性别,年龄等基本资料经对比后无较大差异,具有可比性(P>0.05)。
1.2纳入与排除标准
1.2.1纳入标准:(1)年龄>18岁;(2)患者有便血、腹痛、大便性状改变等典型症状,通过肠镜检查确诊为结肠息肉;(3)患者神志清楚,了解本次实验目的并签署知情同意书。
1.2.2排除标准:(1)合并有心肝肾等重要器官损伤的患者;(2)合并有肿瘤自身免疫性疾病,精神异常的患者;(3)配合度差,依从性差的患者[2-3]。
1.3方法
对照组的患者在电子肠镜的定位下进行腹腔镜辅助的结肠息肉切除。先利用结肠镜插到患者的回盲部后再退镜,之后对已经发现的息肉进行切除。根据息肉直径的大小,采取不同的摘除方式。
而观察组患者则在术前利用电子肠镜开展标记定位,在术前一天进行肠道准备。在术前1天中午后食用无渣的半流质食物,晚上8点前将聚乙二醇电解质溶解在1000ml的温开水内,使其充分溶解并搅拌进行分次冲服使用。在第二日上午5点时,再次重复以上步骤,直至排泄物呈清水样[4]。在电子肠镜的辅助下,运用纳米碳对已经发现的结肠息肉进行标记定位,主要操作步骤是在已经发现的结肠息肉根部粘膜下注射0.1ml的纳米碳,在结肠息肉的同一平面的肠环壁再选择2个点再次注射0.1ml的纳米碳。随后对患者进行静脉输注依托咪酯与丙泊酚。待到麻醉药物起效后,根据肠镜标记的部位确定观察孔的位置之后,利用无损伤的抓钳发现息肉并将其暴露于视野正中部位。通过肠镜上的孔道利用电圈套器套住息肉,轻轻向肠腔内提起息肉,使钢丝圈与内壁粘膜保持一定的距离,并在息肉的根部收紧钢丝圈利用脉冲式通高频电进行电灼烧,将其切断[5-7]。使用金属夹子夹闭创面,避免创面的迟发性出血。取标本送病理进行切片检查。
1.4观察指标
将患者的最终治疗效果分为显效、有效和无效三个类型。显效是指患者经手术治疗后临床症状已经改善,再次进行肠镜检查息肉已全部切除,术后未继发感染等并发症;有效是患者的临床症状得到明显缓解,再次检查息肉大部分切除,未出现感染等症状;无效是患者的息肉未完全切除,且术后有感染,发热等症状的出现。调查统计并对比两组患者在手术中的出血量、平均的住院时间、后续并发症的发生例数[8]。
1.5统计学分析
将以上所采集到的各项数据运用spss 22.0软件进行数据分析,计数资料采用百分数(%)表示,x2检验;计量资料运用(x̄±s)表示,t检验。认为P<0.05时差异具有统计学意义。
2结果
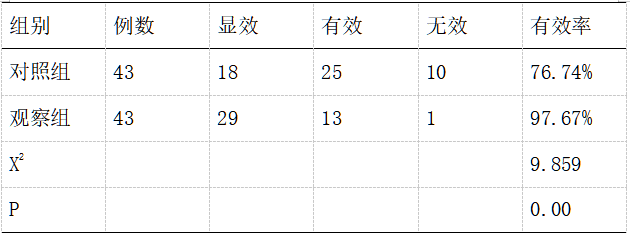
2.1两组患者整体治疗有效率比较。两组患者均顺利完成手术,其中观察组患者的整体有效率为97.67%远高于对照组患者,差异具有显著的统计学意义(P<0.05)。
表1 两组患者整体治疗有效率对比表[n,%]
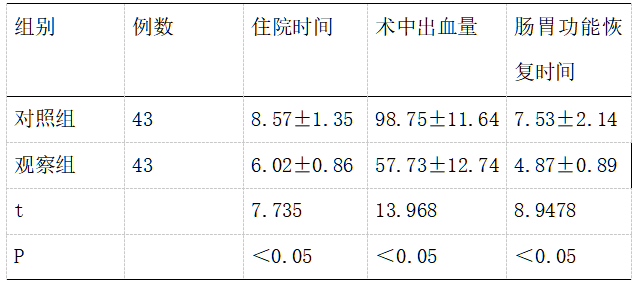
 2.2两组患者手术相关指标比较。两组患者均顺利完成手术,其中观察组患者的术中出血量、胃肠功能恢复时间和整体住院时间均短于对照组患者,差异具有显著的统计学意义(P<0.05)。
2.2两组患者手术相关指标比较。两组患者均顺利完成手术,其中观察组患者的术中出血量、胃肠功能恢复时间和整体住院时间均短于对照组患者,差异具有显著的统计学意义(P<0.05)。
表2两组患者手术相关指标对比表[n,(x̄±s)]
 2.3两组患者手术后并发症发生率比较。观察组的术后发生出血2例,并发症发生率为4.65%;对照组发生肠粘连2例,术后出血4例,穿孔4例,并发症发生率为23.25%,差异具有显著的统计学意义(P<0.05)。
2.3两组患者手术后并发症发生率比较。观察组的术后发生出血2例,并发症发生率为4.65%;对照组发生肠粘连2例,术后出血4例,穿孔4例,并发症发生率为23.25%,差异具有显著的统计学意义(P<0.05)。
3讨论
近年来,结肠息肉已成为消化科中发病率较高的疾病。结肠息肉从病理分型主要分为炎性息肉、腺瘤样息肉、错构瘤型息肉等。但由于息肉有可能演变成癌,因此尽早地发现和治疗结肠息肉,对于预防结肠癌有着至关重要的临床意义。临床上往往是在常规结肠镜的引导下进行息肉的切除,虽然该术式能够切除绝大部分的息肉,但对于一些位置特殊,体积巨大的息肉在内镜下处理时,往往会伴随着结肠穿孔,出血等诸多的术后并发症。随着微创技术的不断发展和应用,腹腔镜下进行结肠息肉的切除,成为临床上的主流术式。但由于结肠息肉为粘膜病变,且息肉质地柔软并整体朝向肠腔内生长,在使用腹腔镜进行切除时很容易出现病变组织定位困难的问题。为了准确定位病变位置,临床上已采用多种方式,例如:在内镜下注射美兰等染料等,这种方式同样是染色定位。但由于染料会持续性的弥散,导致染色范围扩大,术中定位不准确。对于部分患者来说有可能存在过敏的可能性,因此临床应用价值不高。此外还有术中的肠镜定位[9-10],但需要在内镜医师的配合下进行操作,但肠腔的充气导致腹腔镜的操作空间缩小,不仅延长了手术的时间而且使得操作难度加大,对于患者来说整体的治疗体验感不佳。因此,在临床上急需寻找一种简便、准确、可靠的定位方式来开展结肠息肉切除手术。
纳米碳近年来常用于进行淋巴结的追踪,由于理化性质稳定,吸附力强,在利用纳米碳进行胃肠道肿瘤和乳腺癌肿瘤淋巴结的追踪时发现其染色清晰,染色时间持久,且染色边界稳定。因此,考虑将纳米碳借鉴应用到腹腔镜下进行结肠息肉标记定位。通过调整注射剂量和注射部位,能够达到稳定且满意的定位效果。而且纳米碳由于颗粒大,不易进入血管,因此对患者而造成的不良反应较少,对于标记定位的设备要求并不高,且标记过后可以稳定着色长达1周。是一种比较理想的标记定位方式,能够帮助后期主刀医师更好地在腹腔镜下进行结肠息肉的电切手术。
综上所述,利用纳米碳染色标记对结肠息肉进行定位切除可以在一定程度上缩短手术时间,降低术中的出血量,安全性能高,预后良好,值得在临床上进一步推广运用。
参考文献:
[1]王杰强,马德奎.示踪剂亚甲蓝注射液、纳米碳混悬液在乳腺癌前哨淋巴结活检术中的应用研究进展[J].中国当代医药,2022,29(29):37-41.
[2]葛军,赵冰,杨熹,胡萍,华敏.结肠息肉内镜下切除术后迟发性出血止血效果及危险因素分析[J].江苏大学学报(医学版),2022,32(03):262-265
[3]崔小群,晏清,高小英,梅申聪.临床护理路径联合集束化护理模式对内镜下结肠息肉切除病人的影响[J].护理研究,2021,35(02):356-358.
[4]邢玲.内镜下高频电切术、氩离子束凝固术及黏膜切除术治疗结肠息肉的有效性和安全性[J].中国内镜杂志,2020,26(12):29-34.
[5]王斌.无痛结肠镜下治疗结肠息肉电切除手术临床观察[J].中国中西医结合外科杂志,2020,26(04):679-681.
[6]王桂林,俸瑞发.纳米碳在甲状腺癌手术中对甲状旁腺及喉返神经的保护作用[J].中国肿瘤外科杂志,2019,11(06):442-445+449.
[7]张汯,周秩武.纳米碳标记在腹腔镜结肠息肉切除术中的应用效果[J].实用临床医学,2019,20(03):24-25+53.
[8]庄琳,杨晓玲,常江.结肠息肉切除后复发的相关因素研究[J].胃肠病学和肝病学杂志,2019,28(02):223-226+231.
[9]Kurzawa-Zegota, Malgorzata,Sharma, Vyom,Najafzadeh, Mojgan,Reynolds, P. Dominic,Davies, Justin P,Shukla, Ritesh K,Dhawan, Alok,Anderson, Diana. Titanium Dioxide Nanoparticles Induce DNA Damage in Peripheral Blood Lymphocytes from Polyposis coli, Colon Cancer Patients and Healthy Individuals: An Ex Vivo/In Vitro Study[J]. Journal of Nanoscience and Nanotechnology,2017,17(12).
[10]叶轲,李新营,常实,李劲东,王志明.纳米碳在腔镜下甲状腺癌手术中的临床应用[J].中国普通外科杂志,2016,25(05):653-658.




