一、研究背景概述
1.c-Met简述
c-Met是酪氨酸激酶受体的一种,由MET基因编码产生。肝细胞生长因子(HGF)作为c-Met唯一的天然配体,与其结合后激活相关下游通路,参与肿瘤的增殖、迁移、侵袭等方面。
当HGF与c-Met结合时,会激活c-Met胞质内蛋白酪氨酸激酶结构域(PTK),从而使胞质内多种底物蛋白快速磷酸化,最后激活多种下游通路,影响NSCLC细胞的增殖、存货、凋亡、侵袭、迁移和血管生成。当c-Met基因中的剪切位点突变时,会导致含有E3泛素连接酶(c-Cbl)的近膜结构域丢失,进而使MET蛋白泛素化失灵与降解率减低,让下游通路信号传导持续增强,并最终导致癌症。
2.纳米抗体的优势
纳米抗体是骆驼科动物中发现的抗体的一个亚类,是由单个多肽链组成的多功能分子结合支架。纳米抗体优越的性能决定了其在生物医学、食品科学等领域的广泛应用。
纳米抗体的概念最早是在1993年Science杂志由比利时科学家首先发现并报道。在羊驼外周血液中存在一种天然缺失轻链的抗体,该抗体只包含一个重链可变区(variable region of heavy chain, VHH)和两个常规的CH2与CH3区,其水溶性良好,又不像人工改造的单链抗体片段(Single-chain variable fragment, scFv)那样容易相互沾粘或者聚集沉淀。单独克隆并表达出来的VHH结构具有与原重链抗体相当的结构稳定性以及与抗原的结合活性,只有重链可变区没有轻链,仅为传统抗体大小的十分之一,是已知的可结合目标抗原的最小单位。VHH晶体为2.5nm,长4nm。单域抗体的分子量仅为 12–15 kDa,远小于由两条重链和两条轻链组成的普通抗体(150–160 kDa),甚至小于Fab 抗体片段(~50 kDa)和单链可变片段(~25 kDa)。纳米抗体已被证明与抗体一样具有特异性,并且在某些情况下它们更强大。它们很容易使用与抗体相同的噬菌体淘选程序进行分离,从而可以在体外以大浓度培养它们。较小的尺寸和单域使这些抗体更容易转化为细菌细胞进行批量生产,使其成为研究目的的理想选择。另外,由于其体积小,分子量小, 纳米抗体具有组织渗透性高,可快速、均匀扩散,利于其穿透致密组织发挥作用,还有特异性强,亲和力高、对人的免疫原性弱,为各类疾病提供新的治疗方法。
3.原核表达
蛋白质在生物、医药和农业等领域有着广泛的应用,为了获得大量的目的蛋白,我们可以通过基因工程技术将编码蛋白的核酸序列导入到某个宿主细胞,使其大量表达。这种将克隆化基因插入合适载体后导入宿主细胞用于表达大量蛋白质的方法一般称为蛋白质表达技术。蛋白质表达技术在蛋白质纯化、定位,蛋白质的结构域分析及蛋白质的体外功能分析等方面都有应用。
按照宿主细胞来划分,蛋白质表达系统可以分为原核表达系统和真核表达系统两大类。原核表达系统有大肠杆菌表达系统、芽孢杆菌表达系统、链霉菌表达系统。
原核表达系统在生产有价值的重组蛋白、酶和其他生物制品方面具有优势。重组抗体片段作为一种重要的治疗蛋白被用于治疗各种危及生命的人类疾病。在工业开发方面有多种表达平台可以实现其高效表达,其中原核的细菌系统已成为高表达的有希望的宿主。小抗体片段与完整抗体不同,其不需要复杂的翻译后修饰,因此这更适合再原核生产系统中表达。传统微生物技术正在逐步发展并与先进技术相结合,以改进代谢物、重组生物药物和工业酶的生产工艺。大肠杆菌在原核表达系统中最广泛用于生产重组蛋白。在 BL21 (DE3) 中,编码 T7 RNA 聚合酶 (T7 RNAP) 的基因受强 lac-T7 启动子的控制,课题通过已构建的抗CX3CR1纳米抗体原核表达载体,转化DE3大肠杆菌细胞,优化表达条件,实现其在大肠杆菌细胞内的高效表达,这为重组抗c-Met纳米抗体的进一步研究和应用奠定了基础。
在本研究中,我们首先得到了用PCR扩增的方法得到大量目的基因片段(控制c-Met抗体合成的片段),然后用DNA电泳检测分子量的方法分离大小片段并取得目的基因,酶切载体质粒并通过碱基互补配对链接目的基因和载体。然后将连接的质粒加入钙离子处理后的大肠杆菌中(感受态细胞),将转化后的大肠杆菌涂在固体培养基上,形成单克隆菌落,挑取单克隆菌落,扩增后提取质粒,PCR和酶切验证,将验证后的大肠杆菌加入液体培养基,在OD600达到合适状况时加入IPTG,IPTG在本实验中是作为乳糖操纵子系统的开关,诱导蛋白表达。本次实验探究了加入IPTG后的温度和时间对蛋白含量的影响,形成了实验室规模的稳定条件,并初步实现了较好的纯化。
4.研究意义
c-Met基因是细胞癌变以及肿瘤形成的重要因素,c-Met抗体可以识别并抑制癌变的细胞,从而抑制肿瘤的扩增和迁移,纳米抗体相较于普通抗体有更强的灵活性与特异性,可以更好的穿过组织并与抗原结合,从而达到抑制肿瘤的效果。纳米抗体与原核表达的结合可以让纳米抗体的生产成本更低且更加高效。二、研究内容:
1、研究目的与对象
在原核蛋白表达体系中,如E.coli(大肠杆菌表达系统),外源基因通常需要诱导剂的诱导才能进行表达,本课题使用乳糖操纵子系统进行蛋白诱导表达,探索不同温度与时间对蛋白产量的影响。
2、实验原理、方法与步骤
2.1 原理:
本课题使用乳糖操纵子系统作为诱导系统,原核生物绝大多数的基因按功能相关性成簇地排列,且密集于染色体上,共同形成一个转录单位——操纵子,也称基因表达的协同单位。E.coli的乳糖操纵子含Z、Y及A三个结构基因,分别编码β-半乳糖苷酶(β-galactosidase)、通透酶(permease)和乙酰基转移酶(transacetylase);此外还有调控基因:操纵序列O(operator)、启动序列P(promoter);而I(编码Lac阻遏物,Lac repressor)不属于乳糖操纵子。
Lac阻遏物是一种具有4个相同亚基的四级结构蛋白,都有一个与诱导剂结合的位点。在没有乳糖存在时,lac操纵子(元)处于阻遏状态,Lac阻遏物(即下图中的阻遏蛋白)能与操纵基因O结合,阻碍RNA聚合酶与P序列结合,阻止了转录的路径,从而抑制转录启动。而当有诱导剂(这里指IPTG)存在时,诱导剂可与阻遏蛋白结合,使阻遏蛋白构象发生变化,导致阻遏物从操纵基因O上解离下来,RNA聚合酶不再受阻碍,启动子P开始发生转录,启动反应开始发生转录。
在这个操纵子(元)体系中,真正的诱导剂并非乳糖本身。乳糖进入细胞,经β-半乳糖苷酶催化,转变为半乳糖——即生理上的诱导剂。而在实验中,通常选用异丙基硫代半乳糖苷(IPTG)作为诱导剂,IPTG是一种作用极强的诱导剂,不被细菌代谢而十分稳定,因此被实验室广泛应用。
2.2步骤与方法:
2.2.1 转化
在冰上融化BL21(DE3)感受态细胞,感受态细胞保持冰浴状态,在50ul感受态中加入1ug质粒,均匀混合在冰上放置30min,取出后立即放入水浴锅中(42℃),热激90s,再次放入冰浴2min。冰浴后加入200μL的LB培养基,放入摇床(37℃,200rpm/min) 中复苏30nim, 复苏完成后将所有液体加入带有Amp抗性的平板,使用分区法涂布。最后平板放入37℃培养箱培养约16h。
2.2.2单克隆菌株
首先,我们取出含有Amp抗生素的LB琼脂平板,确保平板干燥且无污染。手持移液器,将移液器垂直插入枪头中。使移液器枪头与平板接触角度始终保持在45度左右。轻轻移动枪头到平板的边缘区域,开始划线。最后将平板倒置,放入培养箱中,过夜培养超过12小时。第二天看到我们精心划线后会有单个菌落出现,之后就可以挑取单个菌落以便用于下游各种各样的实验。
2.2.3 诱导表达
从平板中挑取单菌落到Amp培养基中过夜37℃,200rpm/min培养。
在新的Amp培养基中接种过夜菌,接种比例1:100,接种后将试管放入摇床中37℃,200rpm/min,用可见分光光度计测OD600值;在OD600=0.5时加入IPTG,IPTG终浓度1mM,加入IPTG后即为诱导开始,开始计时。
为探索温度与时间对蛋白表达的影响,分别在25℃,30℃下200rpm/min培养,取0h,6h,12h,18h,24h的样品,每次取样500uL离心(8000r/min),5min, 去上清,留沉淀。
在每个离心管中加入500μL的H2O,悬浮沉淀,离心(8000r/min),5min, 去上清,留沉淀。在每支离心管中加入40μL的1×PBS和10μL的5×Loading Buffer悬浮沉淀,放入金属浴(100℃),25min。取出后离心(8000r/min)5min, 取上清进行SDS—聚丙烯酰胺凝胶电泳检测。
2.2.4 电泳表征
SDS-聚丙烯酰胺凝胶电泳( SDS-polyacrylamide gel electrophoresis,SDS-PAGE)实验流程
玻璃板的清洗
一般是先在自来水下,用占有去污剂的海绵擦洗两片玻璃板,后先用自来水冲洗掉去污剂,再用蒸馏水冲洗两遍,注意不要遗留有去污剂,会影响后面制胶。玻璃板竖立放置,风干后,即可制胶使用。
浓缩胶、分离胶的准备,制胶和点样
首先将两块玻璃板放入制胶夹中卡紧,保持玻璃板的竖直,短玻璃板面向外面。
浓缩胶和分离胶的制备:按照表格中溶液的顺序及比例,配置5.0%的浓缩胶(表1)和浓度为12%的分离胶(表2)。分离胶在下层,浓缩胶在上层。等分离胶稳定后,再配置浓缩胶
表1,不同体积的5%浓缩胶配方内容

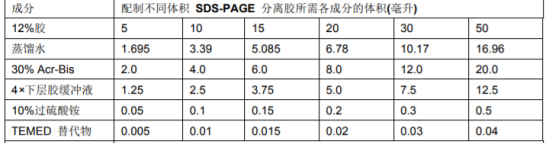 表2,不同体积的12%分离胶配方内容
表2,不同体积的12%分离胶配方内容
按照玻璃板和梳子的尺寸,我们选择分离胶配置10ml;浓缩胶配置6ml。分别将各成份加入小烧杯后,混匀,用移液枪小心将液体灌注到玻璃板中间,避免加入气泡。分离胶灌注要距离短玻璃上缘2cm左右时候停止,用蒸馏水压胶。按照同样方法灌注浓缩胶。浓缩胶灌满后,将梳子缓慢插入,注意避免外溢的浓缩胶溅到皮肤上。将灌注后的制胶架放到阳光下,自然聚合。待到浓缩胶凝固后,轻轻向上拔出梳子,用水冲洗一下制备好的胶板,小玻璃板面向内,大玻璃板面向外将其卡入电泳架上,再放入电泳槽中。形成一个内室和外室,中间是用电泳液贯通,保证电流的环路。
取出前述制备的上样样品至 0.5ml 离心管中,加入 5×SDS 上样缓冲液至终浓度为 1×(用蒸馏水/PBS稀释),上样总体积一般10-20ul,加样孔的最大限度可加 30μl 样品。)上样前要将样品于沸水中煮 5min 使蛋白变性。
将电泳液用去离子水稀释到工作浓度后,填充到内外室内后开始准备点样。用小规格移液枪吸取样品后,缓慢注入加样孔中,避免产生气泡以及气泡外溢造成的样品损失,不同样品加入时候需要更换枪头。
2.2.5 电泳
点样完毕,按照电源的正负极(红色/黑色)接通电源。一般电泳电压顺序是,先90V,大概20分钟,确保样品被压到浓缩胶和分离胶的分界线。后调整电泳到120V,大约45分钟;根据样品中的溴酚蓝指示剂迁移到距分离胶下缘前沿1~2cm处即停止电泳。
2.2.6 SDS-PAGE胶的染色、脱色
电泳结束后,关掉电源,轻轻取出玻璃板,用撬胶板将长短玻璃板分开,然后轻轻将胶取出,放入染色盒中染色,使用0.25%的考马斯亮蓝染液,染色2~4h,必要时可过夜。
弃去染色液,用蒸馏水漂洗胶面数次。加入脱色液,进行扩散脱色,经常换脱色液,直至蛋白质带清晰为止。
三、实验结果与分析
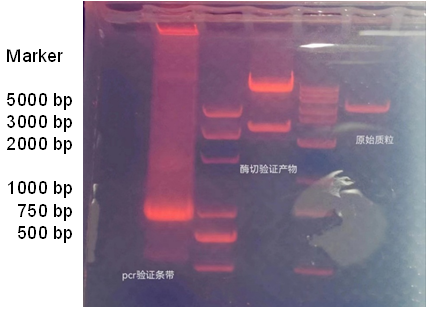
1. 质粒鉴定结果
PCR鉴定,PCR扩增检测,质粒后,PCR产物进行电泳,电泳后观察条带大小正确,清晰、单一,证明PCR过程中无副产物,质粒纯净;
酶切鉴定,通过限制性内切酶切割,酶切完成后进行电泳,观察产物大小
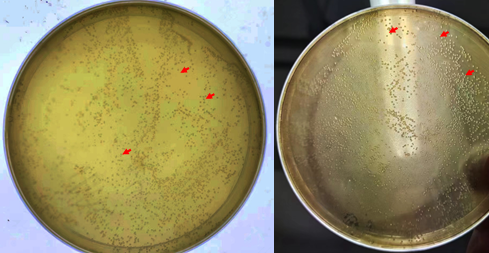
 2. 涂板与单克隆
2. 涂板与单克隆
这是利用改造完成后的大肠杆菌涂板的结果,使用时需要挑单克隆菌落,再放入培养基中培养。
 3. 蛋白诱导表达条件探索结果
3. 蛋白诱导表达条件探索结果
我们使用了25℃,30℃进行培养,25℃和30℃分别培养0小时、6小时、12小时、18小时、24小时。结果如下图:
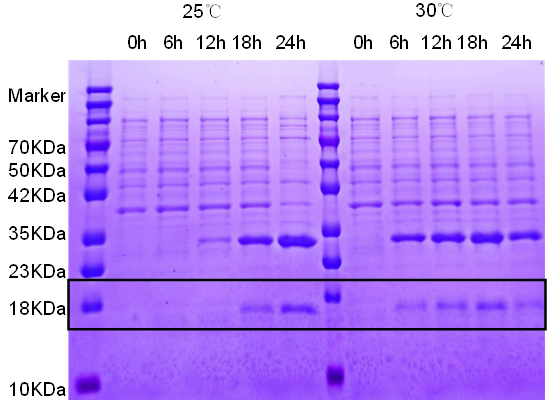 左边5组为25℃,右边5组为30℃,最左边为对照组,通过与对照组水平方向的对比,可以看出25℃时24小时蛋白表达量最高,条带颜色最深,诱导表达效果最好。30℃诱导表达组,在诱导18小时条带颜色最深,诱导表达的效果好。相同时间30℃的效果都高于25℃,因此在一定范围内,提高温度可以促进细菌的蛋白表达,但延长时间不能促进细菌的蛋白表达,因此不同温度要控制不同的时间的组合才能让表达效率达到最优组合。
左边5组为25℃,右边5组为30℃,最左边为对照组,通过与对照组水平方向的对比,可以看出25℃时24小时蛋白表达量最高,条带颜色最深,诱导表达效果最好。30℃诱导表达组,在诱导18小时条带颜色最深,诱导表达的效果好。相同时间30℃的效果都高于25℃,因此在一定范围内,提高温度可以促进细菌的蛋白表达,但延长时间不能促进细菌的蛋白表达,因此不同温度要控制不同的时间的组合才能让表达效率达到最优组合。
4. 蛋白纯化
 在AKTA纯化仪上进行蛋白上样,平衡,洗脱后观察UV吸收峰,出现尖锐的单独的吸收峰,证明蛋白纯化产物纯净,实现了实验室内高纯度蛋白的获得,为进一步应用奠定了基础。
在AKTA纯化仪上进行蛋白上样,平衡,洗脱后观察UV吸收峰,出现尖锐的单独的吸收峰,证明蛋白纯化产物纯净,实现了实验室内高纯度蛋白的获得,为进一步应用奠定了基础。
四、结论
原核表达系统以大肠杆菌为主,通过原核生物来获得外源蛋白,能够在较短时间内获得基因表达产物。该方法操作简便、成熟、高效高产、成本低廉,是目前最为广泛应用的经典蛋白表达系统。本研究通过前期的精准设计,将优选的具有重要临床意义的目的基因克隆到原核表达载体中,转入表达菌株中进行体外诱导表达,在IPTG浓度1mmol/L,25℃诱导24小时后实现了目的基因的高效表达,并可以实现高纯度的纯化。这为重组抗c-Met纳米抗体的研究和应用开发奠定了坚实的基础。
附录:实验记录部分
第一天
配置了液体培养基;16克大豆胰蛋白胨,10克酵母提取物,5克氯化钠,定容到一升,调节pH值至7.2,固体培养基16克大豆胰蛋白胨,10克酵母提取物,5克氯化钠,十六克琼脂糖定容到一升,调节pH值至7.2,并用高压锅进行杀菌(121度20分钟),从大肠杆菌的培养皿中挑取一个单克隆白色菌落,接种到带有氨苄抗生素的培养基中
第二天
我们对昨晚配置并进行接菌的培养基进行观察,刚从震荡培养摇床中取出时,为乳黄色的不透明液体,在进行沉淀后发现大肠杆菌沉淀于试管底部,呈白色斑点状。开始进行二号实验,提取大肠杆菌质粒,使用‘TIANGEN’公司出品的高纯度质粒小提试剂盒,本试剂盒使用的是碱裂解-吸附柱发操作步骤如下;
溶液P1在使用前先加入RNase A(特试剂盒中会提供的RNase A全部加入),混匀,置于2-8 °C保存。使用前先检查平衡液BL、溶液P2和P3是否出现浑油,注意不要直接接触溶液P2和P3,使用后应立即盖紧盖子。所有离心步骤均为使用台式离心机室温下进行离心,速度为12,000 rpm【转速(~13,400xg)】
提取的质粒量与细菌培养浓度、质粒拷贝数等因素有关。实验前使用平衡液处理吸附柱,可以充分激活硅基质膜,提高得率。 用平衡液处理过的柱子最好当天使用,放置时间过长会影响效果。使用前先在漂洗液PW中加入无水乙醇,加入体积请参照瓶上的标签。
柱平衡步骤:向吸附柱CP3中(吸附柱放入收集管中)加入500ul的平衡液BL,12,000 ppm(~13,400x9)离心1min, 倒掉收集管中的废液(记得回收),将吸附柱重新放回收集管中。(请使用当天处理过的柱子)
第一步:
取1-5ml过夜培养的菌液加入离心管中,12,000 rpm (~13,400Xg)离心1min,尽量吸除上清(菌液较多时可以通过几次离心将菌体沉淀收集到一个离心管中)。
向留有菌体沉淀的离心管中加入250ul溶液P1 (请先检查是否已加入RNaseA),使用移液器或涡旋振荡器彻底悬浮细菌细胞沉淀。如果有未彻底混匀的菌块,会影响裂解,导致提取量和纯度偏低。向离心管中加入250ul溶液P2,温和地上下翻转6-8次使菌体充分裂解。注意要温和地混合,不要剧烈震荡,以免打断基因组DNA,造成提取的质粒中混有基因组DNA片断。此时菌液应变得清亮粘稠,所用时间不应超过5min,以免质粒受到破坏。如果未变得清亮,可能由于菌体过多,教解不彻底,应减少菌体量。
第三天:
继续昨天的工作,
向离心管中加入350 ul溶液P3,立即温和地 上下翻转6-8次,充分混匀,此时会出现白色絮状沉淀。12,000 rpm (~13,400xg)离心10 min,用移液器小心地将上清转移到过滤CS柱(过滤柱放入收集管中),注意尽量不要吸出沉淀。
注意:P3加入后应立即混合,避免产生局部沉淀。如果上清中还有微小白色沉淀,可再次离心后取上清。
6. 12,000rpm (~13,400×g )离心2min, 小心地将离心后收集管中得到的溶液转移到吸附柱
CP3中(吸附柱放入收集管中),,(如果过滤柱中有残余的液体说明步骤5吸取的上清中杂质过多,可以延长离心的时间;如果离心后收集管底部有少量的沉淀,尽量的吸取上清)。
7. 12,000 rpm(~13,400 Xg)离心30-60 sec, 倒掉收集管中的废液,将吸附柱CP3放入收集管中。
8.向吸附柱CP3中加入500 pl去蛋白液PD,12,000 rpm (~13,400×g)离心30-60 sec, 倒掉收集管中的废液,将吸附柱CP3放入收集管中。
9. 向吸附柱CP3中加入600ul漂洗液PW,12,000 rpm(~13,400xg)离心30-60 sec, 倒掉收集管中的废液,将吸附柱CP了放入收集管中。
重复操作将吸附柱CP3放入收集管中,12,000 rpm (~13,400×g)离心2min,目的是将吸附柱中残余的漂洗液去除。
注意:漂洗液中乙醇的残留会影响后续的酶反应(酶切、PCR等)实验。为确保下游实验不受残留乙醇的影响,建议将吸附柱CP3开盖,置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
10. 将吸附柱CP3置于一个干净的离心管中,向吸附膜的中问部位悬空滴加50-100ul洗脱缓冲液TB,室温放置2min, 12,000 rpm (~13,400×g)离心2min, 将质粒溶液收集到离心管中。为了增加质粒的回收效率,可将得到的溶液重新加入离心吸附柱中,重复吸附
第四天
质粒酶切验证
1.实验操作程序
酶切操作:
以酶切and连接方式构建质粒:目的质粒,使用NcoI和XhoI两种酶进行反应,目的:获得局部片段,放置37℃恒温箱,2h,然后核酸胶分离观察条带大小
酶切反应体系(37摄氏度水浴条件):
2琼脂糖凝胶电泳分离目的DNA:
材料:1 x TAE;琼脂糖;EB,Mark(5-10ul),Buffer(50ul+10ulBuffer)
1.按照相应配置体系,称量并倒入取锥形瓶,加入1 x TAE溶解;
2.放在微波炉加热至沸腾,两次(第一次约45s,第二次约15s)
3.待稍凉后(切记不能凝固),加入EB,倒入卡槽里面(注意梳子插孔方向)
4.待凝固后,约15min,放入电泳槽(注意拔梳子要小心)。
5. 电压:180V,时间:20min 作者:
6. 质粒PCR验证
第五天
进行转化,将细菌图板转化后进行37度摇菌,调出单克隆菌落
第六天
进行细菌提取,并保存菌落,在进行菌落扩增,配置蛋白胶,对细菌进行纯化,再用高温使蛋白质变形,在进行跑胶。
参考文献
[1]苏志鹏.抗c--MET纳米抗体的抗肿瘤作用研究[D].东南大学[2023-08-06].
[2]孙山,谭星,庞晓燕,等.纳米抗体技术应用的最新进展[J].生物工程学报, 2022, 38(3):13.
[3]]曹珍,李增军,单军奇,等.调控肝细胞生长因子受体c-Met表达对结肠癌细胞生物学潜能的影响[J].中华肿瘤防治杂志, 2022, 29(11):8.
[4]秦蓉芬,贾琼,于雷涛,等.STAT3纳米抗体的制备与功能鉴定[J].中国畜牧兽医, 2023, 50(3):1118-1128.
[5]尚宏丽,孟鑫,张挺.薏米蛋白提取及其SDS-PAGE电泳分析[J].中国农学通报,2012,28(18):260-265.
[6]搜狗百科.纳米抗体.网址https://baike.sogou.com/v56094164.htm;2016-03-25
[7]百度百科.蛋白质印记法.网址http://baike.baidu.com/view/3848548.html;2008-04-20
[8] 百度百科.胶回收试剂盒.网址http://baike.baidu.com/view/9682610.html;1900-01-01
[9]秦浥雯,张嘉仪,吴朝敏,魏勍颋 ,涂追,等。 NANO:一个新型的纳米抗体结构数据库系统 [J].生物信息学,2023-07-25




