引言
支气管哮喘(以下简称哮喘)是一种普遍存在的慢性疾病,据估计,全球每年有大约3.4亿人患有哮喘[1]。其病理特征包括气道炎症、氧化应激和气道重塑[2]。尽管目前临床上广泛使用支气管扩张药和抗炎药来治疗哮喘,但对于一部分患者,这些药物难以缓解和控制症状[3]。因此,有必要深入研究哮喘的发病机制,并进一步开发新的治疗方案。
间充质干细胞具有释放细胞小泡或细胞因子来调节免疫功能的潜在治疗作用[4],对于治疗支气管哮喘可能具有潜力。研究表明,将骨髓间充质干细胞移植到小鼠模型或哮喘患者体内,可以显著减少肺组织重塑和炎症[5-6]。这一效果可能与减轻炎症反应、抑制平滑肌细胞增生等机制有关。与骨髓间充质干细胞相比,人脐带间充质干细胞(UC.MSCs)不仅更容易获取,还可能具有更强的免疫抑制作用[7-8]。最近的研究表明,UC.MSCs能够减少大鼠哮喘肺组织中嗜酸性粒细胞和淋巴细胞的数量,并抑制IL-13、IL-5和IL-4的水平[9-10]。目前,UC.MSCs对哮喘进展的作用机制仍在初步探索阶段。本研究旨在探究UC.MSCs对哮喘模型大鼠的气道炎症和氧化应激的影响,观察Nrf2/HO-1/NF-κB信号通路的活性变化,以进一步研究其作用机制,为揭示UC.MSCs在哮喘的预防和治疗中的作用以及潜在的机制提供实验依据。
1 材料与方法
1.1 实验动物 由浙江省农业科学院购得 SPF 级成年SD大鼠72只,6周龄,
体质量为(200+20) g,许可证号 SYXK(浙)2020-0022。
1.2 药物与试剂 卵白蛋白(ovalbumin,OVA,泉州市睿信生物科技有限公司) ,UC.MSCs(武汉普诺赛生命科技有限公司,瑞氏-姬姆萨复合染液试剂盒)、Masson染色液(北京索莱宝科技有限公司),Nrf2抗体,NF-κB,IL-17 和IL-4 ELISA购自武汉云克隆科技股份有限公司,Trizol、Hifair® Ⅱ 1st Strand cDNA Synthesis SuperMix、Hieff® qPCR SYBR Green Master Mix购自上海翌圣生物科技股份有限公司,引物由 Invitrogen公司合成。
1.3 主要仪器 激光共聚焦显微镜成像系统(Olympus,UltraVIEW VoX & IX81),正置荧光显微镜(Olympus,BX53),酶标仪(RT-6000,雷杜公司),ABI 12K荧光实时定量PCR仪(ABI QuantStudio,12K Flex)。
1.4 方法
1.4.1 哮喘大鼠模型建立及分组 随机将大鼠分为健康对照组(control),模型组(model),地塞米松组(DXMS),UC.MSCs静脉注射组(UC.MSCs (i.v))和UC.MSCs气管滴入组(UC.MSCs (i.t)),每组各10只大鼠。用4%的氢氧化铝凝胶配制浓度为2mg/mL的OVA(V级)溶液,除健康对照组外,大鼠两后足、腹股沟、背部皮下、颈部皮下及腹腔注射OVA 共计0.5mL/只。致敏后第14天,腹腔注射0.2mL含OVA的氢氧化铝凝胶加强致敏。第23天开始雾化吸入10mg/mLOVA生理盐水溶液30min,每周3次,连续8周。健康对照组给予等剂量的生理盐水。当大鼠出现喘息不断、呼吸不稳且急促、行动能力差时评定为模型构建成功。UC.MSCs(i.v)组和UC.MSCs(i.t)组以相同剂量(0.5 mL,含细胞5×106个细胞)的UC.MSCs分别经静脉注射和气管滴入干预哮喘大鼠,DXM组(静脉注射0.5mg/次)每周给药3次,对照组和模型组给予等剂量的生理盐水。连续给药8周。
1.4.2 肺泡灌洗液(BALF)细胞数量检测 末次处理24h后麻醉各组大鼠,迅速处死后解剖大鼠,暴露大鼠气管并插管收集肺泡灌洗液,4 ℃,2000 r/min离心8 min获取沉淀细胞,进行瑞氏-姬姆萨染色和细胞计数,收集数据进行统计分析。
1.4.3 炎症因子及还原型GSH含量测定 取适量组织块,在预冷PBS(0.01mol/L, pH=7.0~7.2)中清洗HOU 切成小块,放入新鲜裂解缓冲液中匀浆后经超声处理。12500 r/min 离心5 min,弃去沉淀获得上清, ELISA法检测IL-4、IL-17和还原型 GSH的含量。
1.4.4 肺组织形态学检测 以10%甲醛固定大鼠肺组织,行常规石蜡包埋,HE、Masson、AB-PAS染色观察哮喘大鼠肺组织及气道周围炎症细胞浸润、黏液分泌及杯状细胞增生情况。
1.4.5 免疫荧光染色检测大鼠肺组织NF-κB和Nrf2表达 肺组织切片干燥后,依次过3道二甲苯(每道5 min),过3道乙醇(每道3 min),洗去
乙醇再进行抗原高压修复,蒸馏水洗3次后画疏水圈。PBS冲洗3次,滴加山羊血清封闭液,孵育后滴加一抗抗体α-SMA(稀释比例为1:300)、NF-κB(稀释比例为1:300)和Nrf2(稀释比例为1:300)再孵育过夜,甩去多余液体,滴加免疫荧光羊抗兔二抗(稀释比例为1:400)孵育,用抗荧光淬灭封片剂封片,数字切片扫描仪进行扫描荧光切片,观察大鼠肺组织α-SMA、NF-κB和Nrf2荧光表达情况。
1.4.6 统计学分析 采用SPSS 26.0处理,定量资料数据用均数加减标准差(x±s)来表示。数据资料满足正态性分布,采用单因素-方差分析法进行统计。定量数据不满足正态性,多组相比采用非参数秩和检验分析,以P<0.05表示两组差异有统计学意义。
2 结果
2.1 UC.MSCs处理对哮喘模型大鼠肺组织病理学和肺部炎症的影响
与control组相比,model组肺组织结构严重破坏,气管壁充满大量炎性细胞,周围渗出物浸润,支气管粘膜下层粘液腺异样增生;与model组相比,DXMS组肺结构形态有所恢复,炎性细胞浸润及渗出物减少,粘膜下层粘液腺增生减少。另外,我们发现UC.MSCs (i.v)组和UC.MSCs (i.t)组支气管管壁结构明显改善,管腔内少量脱落的上皮细胞,炎性渗出物减少,气管壁的结构基本清晰可见(图1A)。与control组相比,model组炎症因子IL-4和IL-17显著升高(图1B,P < 0.001),而与model组比较,DXMS、UC.MSCs (i.v)组和UC.MSCs (i.t)组均逆转了这种促进作用(P < 0.05)。
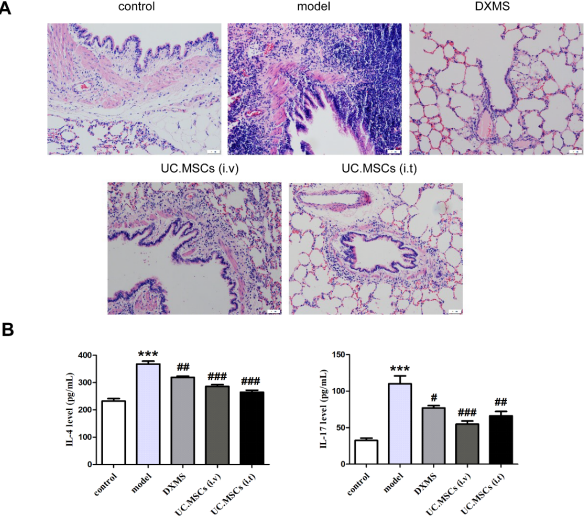
图1 UC.MSCs处理对哮喘模型大鼠肺组织病理学(HE,X200)和肺部炎症的影响
Note: Compared with the control group,***P<0.01;compared with the model group,#P<0.05,##P<0.01,###P<0.001.
2.2 UC.MSCs处理对哮喘模型大鼠BALF炎性细胞数目的影响
瑞氏-姬姆萨染色细胞计数显示(图2A),与control相比,model组BALF中炎性细胞总数显著升高(图2B-D,P < 0.001);与model组相比较,DXMS组、UC.MSCs (i.v)组和UC.MSCs (i.t)组大鼠BALF 中细胞总数显著降低(P < 0.05)。
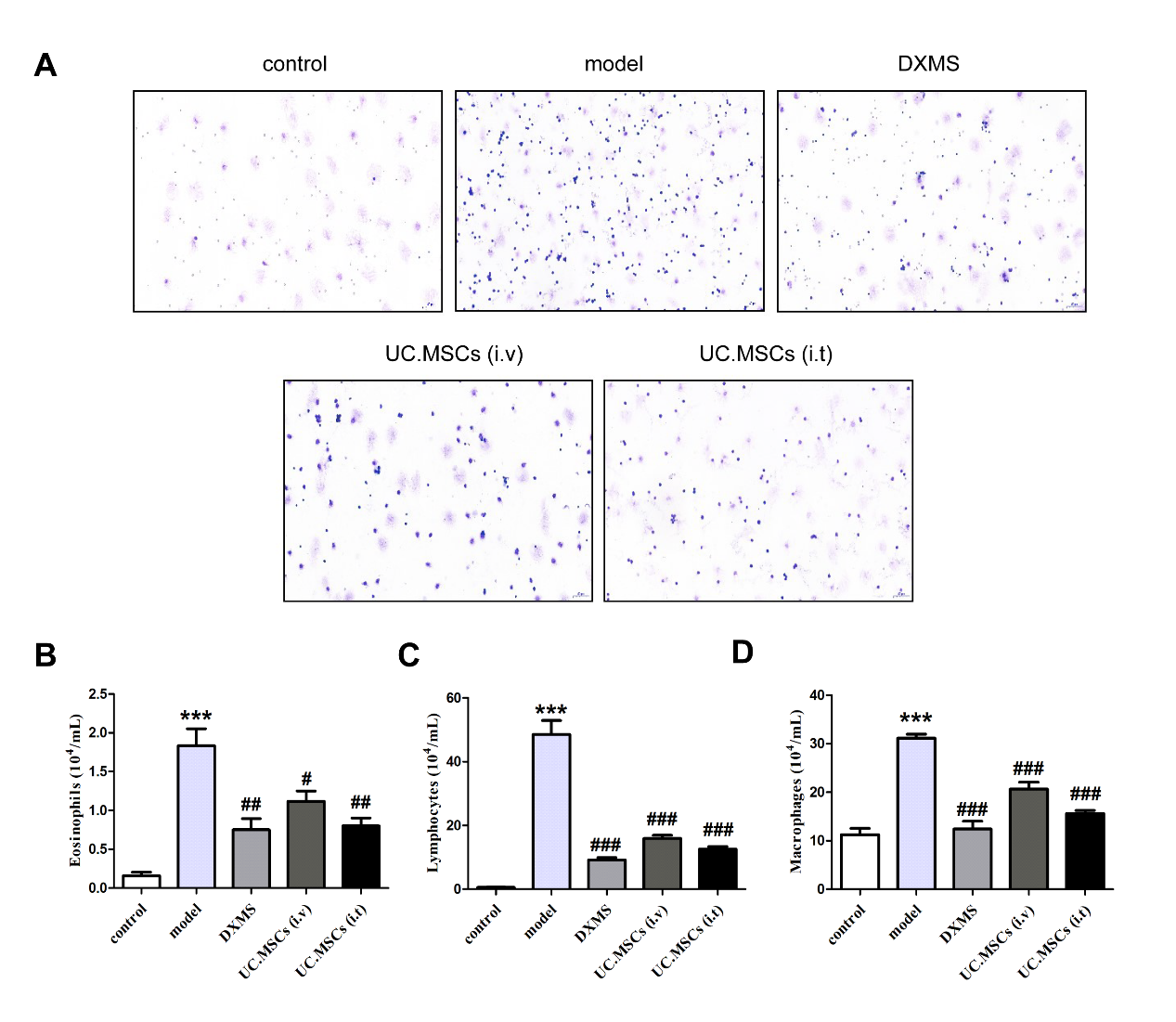
图2 UC.MSCs处理对哮喘模型大鼠BALF炎性细胞数目的影响(X200)
Note: Compared with the control group,***P<0.01;compared with the model group,#P<0.05,##P<0.01,###P<0.001.
2.3 UC.MSCs处理对哮喘模型大鼠肺组织氧化应激水平的影响
如图3A-C,与control组相比,model组大鼠肺组织中NQO1和HO-1表达以及还原型GSH含量降低,差异均有统计学意义(P < 0.001)。与model组相比,DXMS组、UC.MSCs (i.v)组和UC.MSCs (i.t)组大鼠肺组织中上述各因子水平有所升高,差异均有统计学意义(P < 0.05)。
图3 UC.MSCs处理对哮喘模型大鼠肺组织氧化应激水平的影响
Note: Compared with the control group,***P<0.01;compared with the model group,#P<0.05,##P<0.01,###P<0.001.
2.4 UC.MSCs处理对哮喘模型大鼠肺组织NF-κB和Nrf2荧光染色的影响
与control组相比,荧光显微镜下观察到model组大鼠肺组织中绿色荧光更强(NF-κB表达更强)。DXMS组、UC.MSCs (i.v)组和UC.MSCs (i.t)组大鼠肺组织中NF-κB表达较model组明显减弱(图3A)。与这种情况相反,与control组相比,model组大鼠肺组织中Nrf2表达减弱,而在DXMS组、UC.MSCs (i.v)组和UC.MSCs (i.t)组大鼠肺组织中Nrf2表达则有所恢复(图3B)。
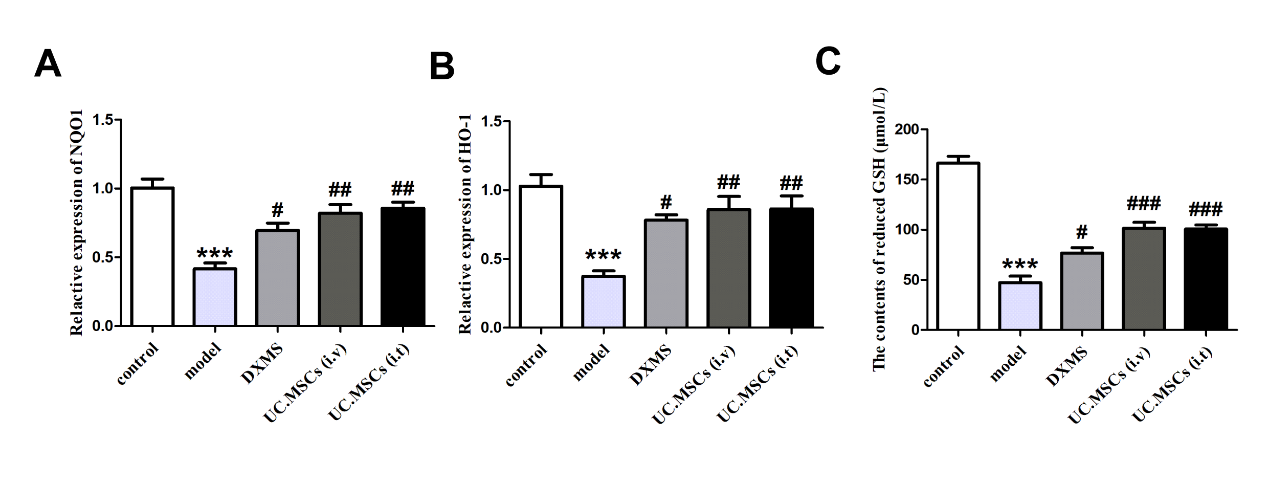
图3 UC.MSCs处理对哮喘模型大鼠肺组织NF-κB和NRF2荧光染色的影响(X400)
3 讨论
近年来,我国哮喘的发病率呈上升趋势。一些哮喘患者,尽管接受了规范的抗哮喘治疗,仍然难以控制临床症状,这被称为难治性哮喘[11]。细胞治疗可能是逆转或延缓慢性肺部疾病进程的新方法[12]。与骨髓间充质干细胞相比,人脐带间充质干细胞(UC.MSCs)不仅易于获取,而且具有更强的免疫抑制作用,因此在全球范围内备受研究关注[13]。
间充质干细胞因其抗炎、再生和免疫调节等多种生理功能而广泛用于急性肺损伤和哮喘等肺部疾病的研究[14]。研究表明,间充质干细胞通过抑制炎症细胞增殖和炎性介质释放,提高调节型T细胞数量等机制,减轻哮喘气道炎症[15]。为验证UC.MSCs在哮喘治疗中的效果,我们选择地塞米松作为阳性对照。HE染色结果显示,UC.MSCs静脉注射、UC.MSCs气管滴入和地塞米松处理后,哮喘大鼠的肺结构形态均有所恢复,炎性细胞浸润和渗出物减少,粘膜下层粘液腺增生减少。同时,肺组织中炎症因子IL-4和IL-17的分泌显著减少,表明UC.MSCs处理能够显著抑制哮喘炎症。有足够的证据表明,抗氧化剂和氧化剂系统之间的失衡可能会加速哮喘的严重程度[16]。通常,NQO1可以直接清除超氧化物,有助于产生抗氧化物以防止氧化应激[17]。HO-1通过抑制氧化应激和维护线粒体完整性来保护机体细胞[18],而还原型GSH被广泛认为是一种重要的自由基清除剂[19]。在这项实验中,我们发现UC.MSCs静脉注射和UC.MSCs气管滴入均能提高哮喘大鼠肺组织中NQO1和HO-1的水平,以及还原型GSH的含量,表明UC.MSCs可以控制哮喘进展中的氧化应激。
Nrf2/HO-1/NF-κB通路是许多人类疾病(如鼻炎、肺气肿和神经炎症)中的主要抗炎和抗氧化通路,尤其是在Cheng等人最近的研究中,抑制NF-κB并促进Nrf2活化有助于恢复香烟烟雾诱导的肺部炎症[20],而Nrf2是HO-1的关键调节剂[21]。由于我们已经证实哮喘大鼠体内HO-1含量发生了变化,因此我们推测UC.MSCs可能与Nrf2/HO-1/NF-κB通路相互作用,从而调节哮喘的发展进程。在这项实验中,我们发现UC.MSCs静脉注射和UC.MSCs气管滴入可以显著抑制NF-κB的产生,但会激活Nrf2水平。这些发现表明UC.MSCs可能与Nrf2/HO-1/NF-κB通路相互作用,影响哮喘的进展。
综上所述,UC.MSCs以两种不同的给药方式都能减轻哮喘大鼠气道炎症,抑制氧化应激,并减弱气道重塑,为UC.MSCs在临床治疗难治性哮喘患者方面提供了一定的理论和科学依据。
参考文献:
1..Gold DR, Adamkiewicz G, Arshad SH, et al.: NIAID, NIEHS, NHLBI, and MCAN Workshop Report: The indoor environment and childhood asthma-implications for home environmental intervention in asthma prevention and management[J]. J Allergy Clin Immunol 140: 933-949, 2017.
2.Poon AH and Hamid Q: Severe Asthma: Have We Made Progress[J]? Ann Am Thorac Soc 13 Suppl 1: S68-77, 2016.
3.Belvisi MG, Hele DJ and Birrell MA: New advances and potential therapies for the treatment of asthma[J]. BioDrugs 18: 211-223, 2004.
4.Fan XL, Zhang Y, Li X and Fu QL: Mechanisms underlying the protective effects of mesenchymal stem cell-based therapy[J]. Cell Mol Life Sci 77: 2771-2794, 2020.
5. 戈霞晖, 白冲. 间充质干细胞发挥治疗作用的机制研究[J]. 广东医学,31(20): 2725-2727, 2010.
6. Hong GH, Kwon HS, Lee KY, et al.: hMSCs suppress neutrophil-dominant airway inflammation in a murine model of asthma[J]. Exp Mol Med 49: e288, 2017.
7. 常琴, 田新利, 霍如婕等. 人脐带间充质干细胞对支气管哮喘大鼠气道重塑的治疗作用及可能机制[J]中华医学杂志,98(28): 2258-2263, 2018.
8. Fan CG, Zhang QJ and Zhou JR: Therapeutic potentials of mesenchymal stem cells derived from human umbilical cord[J]. Stem Cell Rev Rep 7: 195-207, 2011.
9. Chan CK, Lin TC, Huang YA, et al.: The modulation of Th2 immune pathway in the immunosuppressive effect of human umbilical cord mesenchymal stem cells in a murine asthmatic model[J]. Inflamm Res 65: 795-801, 2016.
10. Kang SY, Park DE, Song WJ, et al.: Immunologic regulatory effects of human umbilical cord blood-derived mesenchymal stem cells in a murine ovalbumin asthma model[J]. Clin Exp Allergy 47: 937-945, 2017.
11. Nunes C, Pereira AM, Morais-Almeida M: Asthma costs and social impact[J]. Asthma Res Pract 3: 1, 2017.
12.Moodley Y, Manuelpillai U, Weiss DJ. Cellular therapies for lung disease: a distant horizon[J]. Respirology 16:223‐237, 2011.
13. Hostettler KE, Gazdhar A, Khan P, et al. Multipotent mesenchymal stem cells in lung fibrosis[J]. PLoS One 12:e0181946, 2017.
14. Su VY, Lin CS, Hung SC, et al.: Mesenchymal Stem Cell-Conditioned Medium Induces Neutrophil Apoptosis Associated with Inhibition of the NF-κB Pathway in Endotoxin-Induced Acute Lung Injury[J].
Int J Mol Sci 20:2208, 2019.
15. 王斐, 车春莉. 氧化应激机制在支气管哮喘中的研究进展[J]. 临床肺科杂志,26(09): 1443-1447, 2021.
16. Ross D and Siegel D: NQO1 in protection against oxidative stress[J]. Current Opinion in Toxicology 7: 67-72, 2018.
17. Yachie A: Heme Oxygenase-1 Deficiency and Oxidative Stress: A Review of 9 Independent Human Cases and Animal Models[J]. Int J Mol Sci 222021.
18. Schieber M and Chandel NS: ROS function in redox signaling and oxidative stress[J]. Curr Biol 24: R453-462, 2014.
19. Piao CH, Fan YJ, Nguyen TV, et al.: Mangiferin Alleviates Ovalbumin-Induced Allergic Rhinitis via Nrf2/HO-1/NF-kappaB Signaling Pathways[J]. Int J Mol Sci 21:3415, 2020.
20. Sohrabi F, Dianat M, Badavi M, et al.: Gallic acid suppresses inflammation and oxidative stress through modulating Nrf2-HO-1-NF-kappaB signaling pathways in elastase-induced emphysema in rats[J]. Environ Sci Pollut Res Int 28: 56822-56834, 2021.
21. 张宇飞, 杨帆, 何得伟等. 槐果碱通过AMPK/Nrf-2/HO-1-NF-κB信号传导途径抑制LPS诱导的小胶质细胞细胞炎症反应[J]. 中国兽医学报, 40(11): 2186-2193, 2020.
22. Cheng L, Li F, Ma R and Hu X: Forsythiaside inhibits cigarette smoke-induced lung inflammation by activation of Nrf2 and inhibition of NF-kappaB[J]. Int Immunopharmacol 28: 494-499, 2015.
23.Alam J and Cook JL: How many transcription factors does it take to turn on the heme oxygenase-1 gene[J]? Am J Respir Cell Mol Biol 36: 166-174, 2007.



