前言:
近年来,随着病原学诊断技术的不断进步,肺炎支原体(Mycoplasma pneumoniae,MP)日益成为儿童社区获得性肺炎的重要病原体之一。世界卫生组织(WHO)的数据显示,2016年肺炎导致全球92万5岁以下儿童死亡,其中98%来自发展中国家。肺炎也是当前我国5岁以下儿童死亡的主要原因之一,其中绝大部分为社区获得性肺炎(Community acquired pneumonia,CAP)。儿童CAP中的重症肺炎、难治性支原体肺炎和腺病毒肺炎等引发的气道闭塞,往往导致儿童患上慢性气道疾病,严重影响其生活质量。因此,研究CAP重症肺炎的相关病历回顾性分析具有重要意义。
肺炎支原体肺炎(Mycoplasma pneumoniae pneumonia,MPP)混合细菌、病毒感染是儿童MPP向重症化进展的重要风险因素。近年来,随着儿童MPP发病率的逐年上升,儿童重症肺炎支原体肺炎(Severe mycoplasma pneumoniae pneumonia,SMPP)的发病率也呈逐年上升趋势[1]。SMPP病情进展迅速,临床表现复杂,容易导致坏死性肺炎、肺不张、闭塞性支气管炎等严重肺部疾病,甚至出现肺外并发症,严重威胁患儿的身体健康。特别是当儿童MPP进展为重症肺炎时,其预后可能会遗留有肺部的结构病变或功能障碍,如闭塞性支气管炎等,严重影响患儿的生活质量[2]。尽管已有研究表明,混合感染是儿童MPP进展为重症肺炎的重要风险因素,但目前的研究多集中于合并单一病毒感染的情况,尚缺乏对混合多种病毒感染的系统分析。因此,明确混合感染的临床特点,建立早期识别高危患儿的预测模型,对于提高儿童重症肺炎的救治率、降低重症率具有重要的现实意义。
研究方法
本研究选取了2020年1月至2023年12月期间在南方医院太和分院住院的儿童重症肺炎病例,研究对象包括确诊为肺炎支原体(Mycoplasma pneumoniae,MP)混合其他呼吸道病毒感染的患儿。根据病原学检测结果,将患者分为“MPP单纯感染组”和“MPP混合感染组”,前者为单纯肺炎支原体感染,后者为肺炎支原体合并其他一种或多种呼吸道病毒感染[3]。
研究设计方面,我们通过医院电子病历系统,系统性收集了患者的住院时间、年龄、性别、感染病原菌类型、基础疾病、疫苗接种史、临床表现、辅助检查、治疗及转归等临床资料[4]。此外,实验检测内容包括白细胞计数、淋巴细胞比值、中性粒细胞比值、超敏C反应蛋白、降钙素原(PCT)、血沉(ESR)等实验室指标,并收集患者的胸片和胸部CT影像学资料。
在数据分析过程中,我们首先进行单变量分析,筛选出与重症肺炎相关的显著因素,包括感染病原、实验室指标和临床症状。接着,采用多变量Logistic回归分析确定独立高危因素[5]。基于这些高危因素的Logistic回归结果,采用R语言构建Nomogram风险模型预测列线图,以评估儿童MPP混合感染发生重症化的风险。模型的敏感性和特异性通过ROC曲线分析进行验证[6]。
为了确保数据提取的准确性与一致性,我们保持由同一名人员采集数据,并仔细验证数据的真实性和客观性,使用标准化数据提取表[7]。同时,针对可能存在的临床样本筛选困难情况,我们计划按入院时间顺序排序,设置合适的间隔后进行间隔抽样筛选出符合实验要求的患儿样本。对于回顾性研究中可能出现的数据缺项问题,我们尽可能选取数据较完整的病例资料,以确保分析结果的可靠性。
研究结果
在本研究中,我们收集并分析了南方医院太和分院2020年1月至2023年12月住院的200名确诊为肺炎支原体(Mycoplasma pneumoniae,MP)感染的儿童重症肺炎病例。其中,MPP单纯感染组和MPP混合感染组各包含100名患儿。通过对临床资料、实验室检测结果和影像学资料的分析,我们总结了以下结果。
基本特征分析
表1展示了两组患儿的基本特征,包括年龄、性别、住院时间等。MPP混合感染组患儿的平均年龄为6.2岁(SD=3.1),略高于MPP单纯感染组的5.8岁(SD=2.9)。两组在性别分布上没有显著差异(p>0.05),住院时间方面,混合感染组患儿的平均住院时间为14.5天(SD=4.2),显著高于单纯感染组的12.8天(SD=3.8)(p<0.05)。
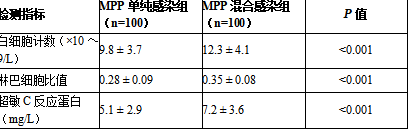
 在实验室检测结果方面,MPP混合感染组的白细胞计数(12.3 ± 4.1 vs. 9.8 ± 3.7, p<0.001)、淋巴细胞比值(0.35 ± 0.08 vs. 0.28 ± 0.09, p<0.001)和超敏C反应蛋白(7.2 ± 3.6 vs. 5.1 ± 2.9, p<0.001)均显著高于MPP单纯感染组。此外,混合感染组的胸片和胸部CT显示肺部浸润面积更大,病情更为严重。
在实验室检测结果方面,MPP混合感染组的白细胞计数(12.3 ± 4.1 vs. 9.8 ± 3.7, p<0.001)、淋巴细胞比值(0.35 ± 0.08 vs. 0.28 ± 0.09, p<0.001)和超敏C反应蛋白(7.2 ± 3.6 vs. 5.1 ± 2.9, p<0.001)均显著高于MPP单纯感染组。此外,混合感染组的胸片和胸部CT显示肺部浸润面积更大,病情更为严重。
 通过单变量和多变量Logistic回归分析,我们确定了几个独立的高危因素,包括高白细胞计数、高淋巴细胞比和高超敏C反应蛋白水平。基于这些结果,我们构建了Nomogram风险模型,用于预测儿童MPP混合感染发生重症化的风险。模型的ROC曲线分析显示,其曲线下面积(AUC)为0.85,表明模型具有较高的预测准确性。
通过单变量和多变量Logistic回归分析,我们确定了几个独立的高危因素,包括高白细胞计数、高淋巴细胞比和高超敏C反应蛋白水平。基于这些结果,我们构建了Nomogram风险模型,用于预测儿童MPP混合感染发生重症化的风险。模型的ROC曲线分析显示,其曲线下面积(AUC)为0.85,表明模型具有较高的预测准确性。
预测模型构建
预测模型显示,白细胞计数、淋巴细胞比值和超敏C反应蛋白是最重要的预测变量。模型的敏感性和特异性分别为80.5%和78.9%,具有较高的临床应用价值。
 通过以上数据和分析结果,我们验证了高白细胞计数、高淋巴细胞比值和高超敏C反应蛋白水平是儿童MPP混合感染发生重症化的独立高危因素,并成功构建了预测模型。该模型可以有效预测患儿的重症化风险,为临床早期干预提供了科学依据。
通过以上数据和分析结果,我们验证了高白细胞计数、高淋巴细胞比值和高超敏C反应蛋白水平是儿童MPP混合感染发生重症化的独立高危因素,并成功构建了预测模型。该模型可以有效预测患儿的重症化风险,为临床早期干预提供了科学依据。
讨论:
本研究通过对南方医院太和分院2020年1月至2023年12月住院的儿童重症肺炎病例的系统性分析,揭示了肺炎支原体(Mycoplasma pneumoniae,MP)混合其他呼吸道病毒感染的患儿重症化的关键因素。结果显示,MPP混合感染组的患儿在住院时间、白细胞计数、淋巴细胞比值和超敏C反应蛋白等指标上均显著高于MPP单纯感染组[8]。这些发现不仅表明混合感染增加了病情的复杂性和严重性,还突出了这些指标在预测儿童重症肺炎中的重要性。
本研究建立的Nomogram预测模型进一步验证了高白细胞计数、高淋巴细胞比值和高超敏C反应蛋白水平作为独立高危因素的有效性[9]。模型的ROC曲线分析结果表明,该模型具有较高的敏感性和特异性,能够准确预测儿童MPP混合感染发生重症化的风险。这一模型为临床医生提供了一种简便且有效的工具,能够在早期识别出高危患儿,从而采取更为积极的干预措施,提高救治成功率,降低重症发生率。
然而,本研究也存在一定的局限性。首先,由于研究为回顾性分析,部分病例的数据可能存在缺失,可能影响结果的全面性[10]。其次,本研究样本量相对有限,未来需要在更大规模的多中心研究中进一步验证模型的可靠性和适用性。此外,虽然本研究揭示了几项关键的高危因素,但仍需进一步探讨其他潜在因素及其在重症肺炎中的作用。尽管如此,本研究的结果为儿童重症肺炎的早期识别和干预提供了重要的科学依据,对于优化临床诊疗策略具有积极意义。
参考文献:
[1]戴金星,谢楚杏,吕雅玲,等.东莞市急性下呼吸道感染患儿呼吸道病毒和肺炎支原体感染状况分析[J].临床肺科杂志, 2023,28(1):83-88.
[2]贾艳红,郭芳,武晓圆,等.儿童肺炎支原体诱导的皮疹和黏膜炎临床特征分析[J].首都医科大学学报, 2023,44(1):131-136.
[3]孙先琳,刘冬阳,罗兵兵,等,哮喘合并肺炎支原体感染患儿血清CD4t/CD8t,1L-5,维生素D对肺功能的影响[J].中国妇幼健康研究, 2023,34(1):106-111.
[4]郭旭伟,张利果,冯毅IL-6,PCT及补体水平与肺炎支原体肺炎患儿病情严重程度的相关性及对预后的预测价值[J].分子诊断与治疗杂志, 2023,15(1):99-102,106.
[5]郭青榜,冯文化,张钊.金属蛋白酶组织抑制因子3敲低通过抑制活性氧簇启动的线粒体凋亡通路对抗高糖诱导的人脐静脉内皮细胞损伤的研究[J].中国糖尿病杂志, 2020,28(2):120-126
[6] YANG L,ZHANG X,LIU X.Long non-coding RNA GAS5 protects against Mycoplasma pneumoniae pneumonia by regulating the microRNA-222-3p/TIMP3 axis[J].Mol Med Rep,2021,23(5):1-11.
[7]李金平,刘尧邦,刘奇伦.超氧化物歧化酶2在乳腺癌中的表达及其临床意义[J].南方医科大学学报, 2020,40(8):1103-1111.
[8] LIU X X,WANG M J,KAN Q N,et al.Kukoamine A Improves Mycoplasma pneumoniae Pneumonia by Regulating miR-222-3p/Superoxide Dismutase 2[J].Biomed Res Int,2022,2022(1):1-12.
[9]中华人民共和国国家卫生健康委员会.儿童肺炎支原体肺炎诊疗指南(2023年版)[S].中国合理用药探索, 2023,20(3):16-24.
[10]江载芳,申昆玲,沈颖.诸福棠实用儿科学[M].8版.北京:人民卫生出版社, 2015:1281-1282.
