铁缺乏症(ID)是体内长期铁负平衡的结果,最初引起体内贮存铁耗尽,继之红系细胞内发生缺铁,称为缺铁性红细胞生成,最后才发生缺铁性贫血(IDA)。IDA 是体内贮存铁缺乏影响血红素合成所引起的贫血。由于铁调素是一种铁的负性调节激素,可以降低机体铁水平,因此其本身作为一种外源性药物可以用来治疗铁过载疾病。目前铁调素主要由高效液相色谱法从尿液中提取、人工化学合成以及基因工程制药的获得方式[1]。随着铁调素在铁代谢中作用的阐明,将其开发为治疗铁代谢紊乱疾病的一项新药成为人们研究的焦点。选取2017年3月至2019年2月我院收治的IDA患者40例和慢性病贫血(ACD)患者40例,进行血清铁调素水平对比分析,现报道如下。
1 一般资料
1.1 临床资料
选取2017年3月至2019年2月我院收治的IDA患者40例(IDA组)和ACD患者40例(ACD组)作为研究对象,其中IDA组男18例,女22例,年龄28~67岁,平均(52.4±3.6)岁;ACD组男19例,女21例,年龄29~66岁,平均(53.2±3.8)岁,并选取同期来本院的50例体检健康人群作为对照组,男24例,女26例,年龄26~68岁,平均(52.6±4.2)岁,各组在年龄、性别等一般资料上比较差异无统计学意义(P>0.05),具有可比性。
1.2方法
抽取受检者晨起空腹静脉血3mL,不抗凝。各组均采用酶联免疫吸附试验(ELISA)检测血清铁调素水平,试剂盒购自美国ADL公司。采用亚铁嗪比色法检测血清铁、总铁结合力(TIBC)水平,试剂盒购于北京雷根生物技术有限公司。对各组血清铁调素水平进行对比,并对各项指标用于诊断IDA和ACD的相关参数进行分析。
2 结果
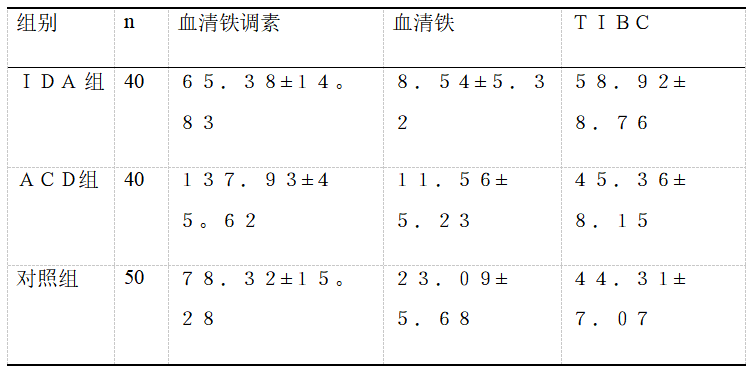
2.1 各组血清铁调素水平、血清铁水平、TIBC水平比较
表1 各组血清铁调素水平、血清铁水平、TIBC水平比较
2.2各项指标用于诊断IDA和ACD相关参数
铁调素、血清铁、TIBC用于ACD 与IDA 患者鉴别诊断的受试者工作特征曲线(ROC)的曲线下面积(AUC)分别为0.98、0.67、0.86。
2 讨论
ACD症状和体征是因为红细胞输送氧气减少,导致组织缺氧现象和代偿性的心输出量增加所引起。长期贫血还可能引起左心室肥大、心脏衰竭、凝血异常和免疫功能缺损。慢性肾脏病的患者有较高的心血管疾病发生率,是目前已广为被接受的观念,且在多项观察性的研究中显示,慢性肾脏病合并贫血患者有较高的概率发生脑中风与心肌梗死。红细胞生成素约90%由肾脏皮质肾小管旁的纤维母细胞制造,ACD发生的主要原因是红细胞生成素的量相对于贫血的程度,其分泌仍然相对不足,而红细胞生成素接受器存在骨髓内红细胞先驱细胞。另外,慢性肾脏病患者长期处于慢性炎症状态,抑制红细胞增长,由抑制红细胞生成素的转译,直接毒杀红细胞前驱细胞,抑制前驱细胞膜上红细胞生成素接受器的表达,或抑制其他造血干细胞的刺激因子[2]。缺铁性贫血患者出现肾性贫血的原因还包括慢性炎性反应、慢性出血、副甲状腺功能亢进合并骨髓纤维化,铝中毒,红细胞病症如地中海贫血、镰刀型贫血,叶酸和左旋肉酸缺乏,营养不良,恶性肿瘤,溶血症以及使用血管张力素转化酶抑制剂和透析不足等。铁调素可以结合细胞表面的膜铁转运蛋白Ⅰ,然后诱导其内吞降解,这种作用类似于配体和受体的作用方式,因此可以设计铁调素的拮抗剂来抑制其发挥作用,用于治疗铁缺乏疾病。但目前市场上抗铁调素的抗体仅仅用于科学研究,尚没有研究机构开展其对缺铁性疾病的治疗研究工作[3]。
铁调素的缺乏是铁色素沉着病的标志,它与跨膜转铁蛋白结合,包括内部作用和退化,过量的铁可累及几乎任何组织,当其储存在肝脏、甲状腺、垂体、下丘脑、心脏、胰腺和关节的时候会对该组织产生损害。本研究表明,IDA 组血清铁调素水平低于对照组;ACD组血清铁调素水平明显高于对照组;IDA组、ACD组血清铁水平均低于对照组;IDA组TIBC水平高于对照组,差异有统计学意义(P<0.05)。铁调素、血清铁、TIBC 用于ACD 与IDA患者鉴别诊断的ROC曲线下面积分别为0.98、0.67、0.86。因此,血清中铁调素水平为鉴别诊断IDA和ACD的简单易行方法,其诊断准确度优于血清铁和TIBC水平。
参考文献
[1]徐康,张翠梅,黄连红,等.6~12月龄婴儿缺铁性贫血的危险因素分析及对神经心理发育的影响[J].中国当代儿科杂志,2015,14(8):830-836.
[2]董俐坤,顾全凯,袁志香.番茄红素对缺铁性贫血大鼠铁利用和抗氧化作用研究[J].中药药理与临床,2015,12(2):27-31.
[3]汪文娟,王浩,陈哲,等.Hepcidin在老年缺铁性贫血和慢性病贫血中的诊断价值[J].中国实验血液学杂志,2015,23(1):155-158.










