1. 引言:
原发性肝癌是全球高发的恶性肿瘤之一,位列全球第六大常见癌症和第三大癌症相关死亡原因。肝癌起病隐匿且进展迅速,目前绝大多数患者在确诊时已处于中晚期,失去了手术治疗的机会,平均存活时间仅为6至8个月。肝癌的发生是一个多因素、多阶段的复杂过程,与多个细胞信号通路中大量基因表达异常有关。成纤维细胞生长因子(FGF)家族及其受体(FGFRs)信号通路参与多种生物学活动,在伤口修复、再生、促进正常组织的发育维持等方面具有重要作用1。该信号通路失调与多种恶性肿瘤的发生、增殖、转移和分化有关,且常见于肝癌发生发展和肝硬化以及病毒性肝炎2。目前针对FGF/FGFR信号通路的研究已经取得了一定的进展,竞争性抑制FGFR激酶活性已被证明是一种重要的肿瘤治疗手段3。本文详细介绍了FGF家族和FGF/FGFR信号通路,并总结了FGF/FGFR信号通路在肝癌中的研究进展。
2.1 概况
原发性肝癌是一种组织学特征各异、预后不良的恶性肿瘤,包括肝细胞癌(HCC)、肝内胆管癌和肝母细胞瘤4。其中,HCC是最常见的原发性肝癌病理类型,在不同国家和地区约占原发性肝癌的70%~90%,其恶性程度高,易发生转移,生存率低4。据最新数据统计,2022年全球新增癌症病例数达到2,000万例,死亡病例970万例。因患肝癌而死亡的人数达到76万人,占癌症死亡总数的7.8%,是全球第六大常见癌症和第三大癌症相关死亡原因5。我国是肝癌高发国家,2022年新增肝癌病例高达37万,死亡病例32万,发病率排名升至全球第4位,且死亡率仍高居全球第2位5。
2.2 肝癌的病因
原发性肝癌的发病率在全球范围内持续上升,对人类健康构成了严重危害。HCC是原发性肝癌的主要组织学亚型,其病因多样,包括病毒性肝炎、酒精性肝病、非酒精性脂肪肝病、肝硬化和遗传代谢疾病等6。对肝癌病因学的研究不仅有助于揭示癌症发生的机制,也对预防和治疗策略的制定至关重要。病毒感染是HCC的主要病因之一。乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)引起的慢性感染是引发肝癌的主要风险因素4。全球约有50%的HCC病例与HBV感染相关,尤其在亚洲和撒哈拉以南非洲地区,HBV携带者的HCC风险比普通人群高出100倍。而HCV则是西方国家HCC的首要病因7。病毒性肝炎通过持续的肝细胞损伤、再生和炎症反应,导致细胞基因突变和肿瘤发生8。酒精性肝病是另一重要病因,长期过量饮酒可导致肝细胞损伤和纤维化,进而发展为肝硬化和HCC9。酒精代谢产生的乙醛和活性氧可以损伤DNA,促进肿瘤发生。非酒精性脂肪肝病和更严重的非酒精性脂肪性肝炎与肥胖、II型糖尿病和代谢综合征紧密相关,已逐渐成为发达国家HCC的主要病因9。肝硬化是肝癌发展的一个重要中间环节,肝硬化的肝脏结构改变和再生结节形成提供了癌变的土壤10。此外,部分遗传代谢疾病如血色病、Wilson病和α1-抗胰蛋白酶缺乏症等也与肝癌风险增加相关11。这些风险因素都可能会导致细胞周期失调、DNA甲基化、染色体不稳定、肿瘤相关基因激活等,进而导致肝癌的发生发展4。
HCC的形成与演变涉及一系列错综复杂的阶段,与众多慢性肝病有关,通常包括慢性炎症损害,如肝细胞坏死与再生,以及纤维组织的增生,且通常发生在肝硬化的背景下12–14。肝硬化向HCC转变的过程遵循一个明确的病变顺序:最初形成低级别的肝脏发育不良结节;随着时间的推移,这些低级别的结节可能进展为高级别的发育不良结节;进一步恶变,转化为早期的HCC;不受控制的肿瘤增长和基因变化可能引导早期HCC向晚期转变15。HCC的致病过程涉及肝细胞的增殖、分化、凋亡的分子级调控以及基因组稳定性维持过程中出现的各类遗传异常12,16。HCC发生的关键途径涉及Wnt/β-catenin信号通路、P53细胞周期调控通路、表观遗传调控因子、氧化应激反应、PI3K/AKT/MTOR以及RAS/RAF/MEK/ERK等信号通路的突变16。肝癌的病理机制还与癌基因的激活、肿瘤抑制基因的不活化及表观遗传学的变化紧密相关12。此外,肿瘤微环境,包括局部的细胞间相互作用、细胞外基质的改变以及相关的炎症介质,也在肝癌的发展中扮演了重要角色17。
3. FGF和FGFR家族
3.1 FGF家族成员及分类
FGF是一种广谱有丝分裂原,作为多肽配体,可以旁分泌或内分泌方式发挥作用。FGF与FGFR介导的信号轴相互作用,刺激或维持代谢、组织稳态和发育所需的特定细胞功能1。哺乳动物FGF家族包含23个成员,所有成员都有一个约140个氨基酸的核心区域。根据其氨基酸序列的相似性和功能差异,FGF家族可进一步细分为5个旁分泌亚家族(FGF1亚家族、FGF4亚家族、FGF7亚家族、FGF8亚家族和FGF9亚家族)、1个内分泌亚家族(FGF19亚家族)和1个细胞内非分泌亚家族(FGF11亚家族)(表1)18。其中,FGF11亚家族成员虽与其它FGF成员具有很高的序列相似性,却缺少分泌信号肽,不具备从细胞中分泌的能力,不能启动任何FGFR信号通路。在肝细胞癌中高表达的有FGF2、FGF5、FGF8、FGF9、FGF17、FGF18和FGF19,它们通过与受体FGFR结合发挥作用19。
3.2 FGFR家族成员及结构
迄今为止,已鉴定出5种FGFR家族成员,其中FGFR1、FGFR2、FGFR3和FGFR4为单体跨膜蛋白,包含一个大的胞外配体结合域(ECD),一个单体跨膜螺旋结构域和一个胞内酪氨酸激酶结构域20;而FGFR5为没有细胞内结构域的截短FGFR。ECD由3个免疫球蛋白(Ig)样结构域(I-III)、酸性结构域、FGF的肝素结合基序组成。在FGFR1、FGFR2和FGFR3的Ig III结构域后半部分的可变剪接可产生b和c亚型,它们具有不同的FGF结合特异性(表1)21。
表1 FGF家族及分类
旁分泌 | 内分泌 | |||||
FGF1亚家族 | FGF4亚家族 | FGF7亚家族 | FGF8亚家族 | FGF9亚家族 | FGF19亚家族 | |
FGF1 | FGF2 | FGF4 FGF5 FGF6 | FGF3 FGF7 FGF10 FGF22 | FGF8 FGF17 FGF18 | FGF9 FGF16 FGF20 | FGF19 FGF21 FGF23 |
|
|
|
|
|
|
|
所有受体均有活性 | FGFR1c、3c>2c、1b、4 | FGFR1c、2c>3c、4 | FGFR2b>1b | FGFR3c>4>2c>1c>3b | FGFR3c>2c>1c、3b>>4 | 活性弱 |
3.3 FGF/FGFR信号通路
FGF配体与FGFR的胞外结构域结合,触发FGFR发生构象变化,通过磷酸化FGFR胞质尾部内的酪氨酸残基,导致胞质酪氨酸激酶的二聚化和活化;随后,FGFR胞质激酶磷酸化FGFR底物2(FRS2),并通过激活磷酸肌醇3(PI3K)/ATK和丝裂原活化蛋白激酶(MAPK)启动下游信号传导22。FGF/FGFR信号通路参与多种生物学活动,包括胚胎发育、细胞增殖、分化、存活、血管生成和迁移等1。
4 FGF/FGFR通路在肝癌中的研究进展
FGF/FGFR通路异常与多种恶性肿瘤的发生、增殖、转移和分化密切相关,其异常主要由旁分泌FGF家族蛋白表达失调,以及FGF、FGFR或辅助因子基因的遗传改变(如扩增、突变、染色体易位或融合)所导致19。据统计,约15~20%的乳腺癌患者出现FGF3的异常扩增,这被认为与癌细胞的侵袭性增加有关;约50~60%的浸润性膀胱癌患者携带FGF3突变;约10%的子宫内膜癌患者存在FGF2突变;约10%的激素受体阳性乳腺癌和10~20%的鳞状非小细胞肺癌患者存在FGFR1畸变。此外,FGF配体过度表达在各类癌症和肿瘤中也很常见,如约15~20%的多发性骨髓瘤患者过度表达FGFR3,约54%的前列腺癌患者被发现异常表达FGF623。
HCC通常发展于慢性肝病的背景下,特别是肝硬化和慢性肝炎。这些病状会导致肝脏长期受损、持续炎症以及肝细胞的不断增生13。这样的环境会改变正常的细胞信号传递路径,为肝癌前期病变的发展创造有利的条件。且前期病变对生长因子的响应性增加,促进了细胞增殖的加速和细胞死亡的减缓,为癌细胞的生长与扩散创造了有利条件24。肝癌的发生依赖于肝硬化中肿瘤特异性微环境的发展,该微环境由炎症细胞、小血管、肌成纤维细胞和细胞外基质组成25。肝癌早期和晚期的上皮-间充质相互作用是由多种生长因子及其受体驱动的26。除了肝细胞生长因子和胰岛素样生长因子诱导的信号通路外,异常的FGF/FGFR信号通路在肝脏肿瘤及其基质的发展中发挥着重要的作用27。
越多的研究数据表明,FGF/FGFR信号通路的异常可能与肝癌的发生有关。其中,FGF19/FGFR4信号通路已被发现通过多种途径促进HCC细胞的生存、增殖、侵袭和转移。该信号通路依赖于β-klotho跨膜共受体的表达,FGF19与FGFR4结合后,与FRS2协同作用招募生长因子受体结合蛋白2(GRB2),激活细胞内不同的下游通路,包括MAPK、PI3k/Akt、PLC-γ和NF-κB信号通路等,从而抑制细胞凋亡,促进细胞增殖,启动肿瘤生长(图1)28。约30%的HCC患者被发现存在FGF19/FGFR4信号通路异常19。Chen等人研究发现,敲除FGFR4可显著降低促癌基因SOX18介导的HCC的侵袭和转移,而FGF19作为FGFR4的配体可以上调SOX18的表达,由此确定FGF19-SOX18-FGFR4正反馈环在HCC转移中起关键作用29。因此,FGFR4被认为是治疗肝癌的一个潜在靶点。
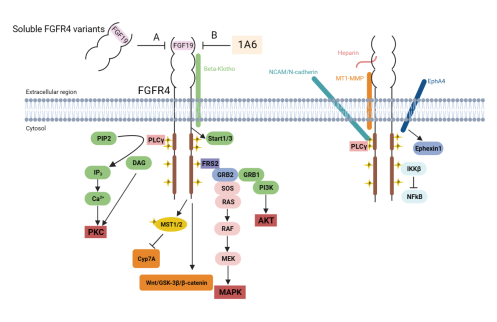
图1 FGF19/FGFR4在肿瘤中激活下游通路。FGF19与受体FGFR4结合激活MAPK、PI3k/Akt、PLC-γ和NF-κB信号通路进而抑制细胞凋亡并促进细胞增殖,启动肿瘤生长。图的左边参与细胞增殖,存活信号通路,右边是细胞迁移途径。
鉴于异常的FGF/FGFR信号通路在肝癌发生中的作用,FGF/FGFR信号轴的抑制剂可能有望用于HCC治疗,减缓或阻止HCC肿瘤生长,靶向血管生成和转移,并逆转对抗癌药物的获得性耐药27。目前多种靶向FGFR的抑制剂,如多激酶抑制剂、泛FGFR抑制剂和特异性FGFR4抑制剂,被证实可以通过抑制FGFR介导的信号转导,从而实现抑制细胞增殖和迁移、阻滞细胞周期、诱导凋亡和抗血管生成等多种抗肿瘤效应30。目前在临床上用以治疗肝癌的分子靶向药物如索拉菲尼、伦伐替尼、瑞戈替尼等都是FGFR抑制剂27。
5总结和展望
肝癌的发生发展是一个多因素多阶段的复杂过程,涉及多个细胞信号通路和大量基因表达的异常。FGF/FGFR信号通路的失调常出现在肝癌的发生发展、肝硬化以及病毒性肝炎中。FGFR抑制剂通过直接抑制FGFR激酶活性和阻断下游信号传导途径,为治疗肝癌提供了一种有前景的治疗策略。










