按化学药品地方标准上升国家标准第十二册所载小儿氨酚烷胺颗粒含量检测,对乙酰氨基酚、咖啡因和马来酸氯苯那敏是在一个系统中测定,对乙酰氨基酚和咖啡因具有良好的分离度和专属性,但马来酸氯苯那敏色谱峰与辅料蔗糖的色谱峰分离度达不到要求,故将马来酸氯苯那敏分开,另拟色谱条件进行测定,修改后的标准采用高效液相色谱法测定,为了更确切地了解小儿氨酚烷胺颗粒含量测定方法的可靠性,我们对含量测定的方法进行了方法学研究,结果显示,该方法的重复性好,专属性强,操作简便、快速、准确,适用于该制剂的质量控制。修改后的标准如下:
【含量测定】马来酸氯苯那敏照高效液相色谱法(中国药典2020年版)测定。
色谱条件与系统适应性试验用十八烷基硅烷键合硅胶为填充剂;以乙腈-0.03mol/l磷酸氢二铵(用磷酸调pH至2.8)(25:75)为流动相;检测波长为214nm。理论板数按氯苯那敏峰计算不低于2000,马来酸氯苯那敏峰的分离度应符合要求。
对照品溶液的制备取马来酸氯苯那敏对照品12.5mg,精密称定,置50ml量瓶中,加流动相适量使溶解并稀释至刻度,摇匀,精密吸取1ml,置50ml量瓶中,加流动相稀释至刻度,摇匀,即得。
供试品溶液的制备取样品细粉约1g,精密称定,置25ml量瓶中,加流动相适量,超声处理15分钟,取出,放置室温,加流动相稀释至刻度,摇匀,滤过,取续滤液,即得。
测定法精密量取对照品溶液与供试品溶液各25μl,分别注入液相色谱仪,记录色谱图,按外标法以峰面积计算。
1.1阴性及蔗糖辅料
称取1.0g缺马来酸氯苯那敏的阴性样品,同供试品处理、测定,结果阴性无干扰。另称取0.8g蔗糖辅料,同供试品处理、测定,结果辅料无干扰。
1.2线性
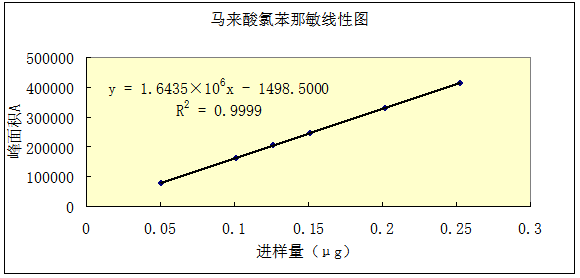
精密称取马来酸氯苯那敏对照品12.65mg(含量99.7%,折算后即为12.61mg),置50ml量瓶中,加流动相使溶解并稀释至刻度,摇匀,精密吸取1ml,置50ml量瓶中,加流动相稀释至刻度,摇匀,精密吸取10、15、20、25、30、40、50μl注入液相色谱仪,记录色谱图,以峰面积A为纵坐标,进样量为横坐标,绘制线性曲线,结果马来酸氯苯那敏在进样量为0.05044~0.2522μg范围内呈良好线性关系,其线性回归方程为:A=1.6435×106C-1498.5000,r2=0.9999。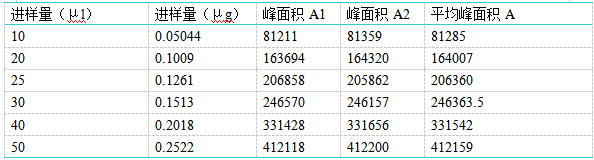
 1.3回收率
1.3回收率
称取0.5g供试品6份,置25ml量瓶中,精密加入对照品溶液(浓度为0.02522mg/ml)3ml后,同供试品处理,结果马来酸氯苯那敏平均回收率为99.7%,RSD%为1.7%。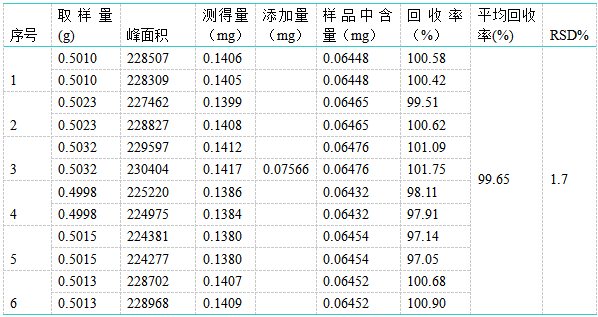 1.4重复性
1.4重复性
称取1.0g供试品6份,置25ml量瓶中,同供试品处理,结果该方法的重复性良好,RSD%为0.5%。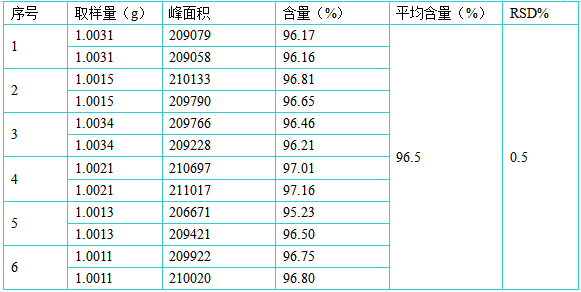 1.5精密度
1.5精密度
连续6次对马来酸氯苯那敏对照品溶液的进样结果显示,仪器精密度良好,RSD%为0.2%。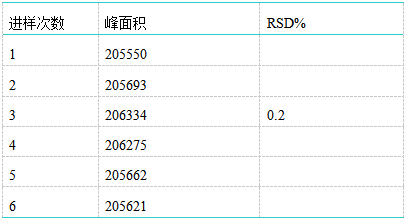 1.6稳定性
1.6稳定性
对供试品溶液分别在0h、2h、4h、6h、8h、10h、12h、24h进行稳定性试验,结果供试品溶液在以流动相为介质的溶液中具有良好的稳定性。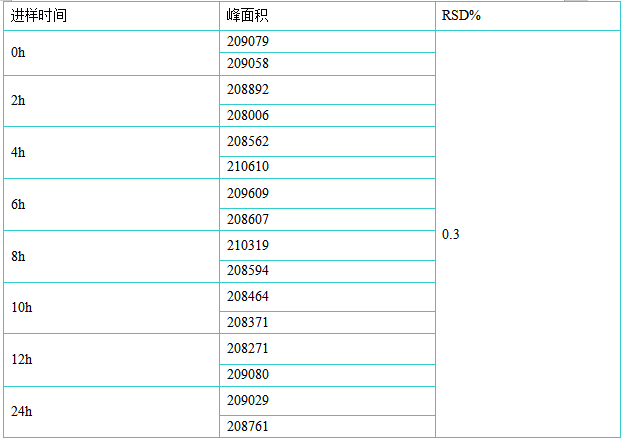 1.7检出限
1.7检出限
精密吸取对照品溶液(精密称取对照品12.61mg,置50ml量瓶中,加流动相使溶解并稀释至刻度,摇匀,精密吸取1ml,置50ml量瓶中,加流动相稀释至刻度,摇匀,精密吸取1ml置100ml量瓶中,加流动相稀释至刻度,摇匀,即得,浓度为0.05044ng/μl)5μl,记录色谱图,计算即得检出限为0.2522ng。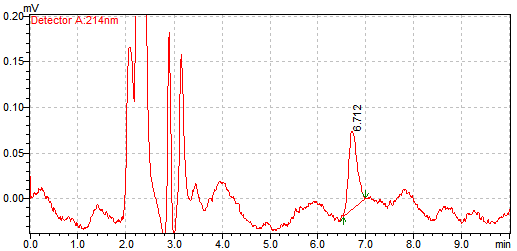 1.8样品测定结果
1.8样品测定结果
根据上述拟定质量标准对3批次小儿氨酚烷胺颗粒进行含量测定,结果均在规定范围之内,且精密度良好。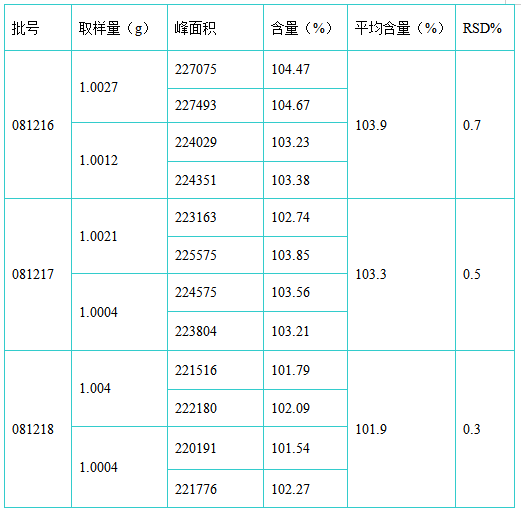 结论
结论
通过实验证明高效液相方法的精密度、准确度、重现性等均较好,溶液的稳定性也良好,马来酸氯苯那敏在进样量为0.05044~0.2522μg范围内呈良好线性关系,其线性回归方程为:A=2×106C-1498.5,r2=0.9999;以该方法测得的平均回收率为99.7%,RSD为1.7%,由回收率测定及样品测定结果可知,各组分互不干扰,能够达到完全分离,辅料对测定无干扰。本法重复性好,专属性强,操作简便、快速、准确,适用于该制剂的质量控制。
参考文献:
1国家药典委员会.中华人民共和国药典2020年版.中国医药科技出版社。
作者简介:陈海丹,1986年7月,女,本科,工程师,从事药品研究开发工作。










