活络镇痛片为中药成方制剂,收载于《国家药品标准》。是属于中成药类非处方药物,其作用主要用于闪腰岔气、淤血作痛,筋骨疼痛、腰痛、腿痛等症状的治疗。活络镇痛片是复方制剂,药物组成包括天南星、红花、防风、白芷、当归等。[1]根据活络镇痛片给药途径和处方,应进行需氧菌总数、霉菌和酵母菌数的测定以及控制菌(耐胆盐革兰阴性菌 、大肠埃希菌、沙门菌)的微生物限度检查。
1 试验仪器、材料与方法
1.1 试验仪器
BSC-1360IIA2生物安全柜(北京东联哈尔),IC812C电热恒温培养箱(雅马拓),IN612C低温恒温培养箱(雅马拓)SQ510C立式高压蒸汽灭菌器(雅马拓),JY20002分析天平(上海良平)。
1.2 试验材料
1.2.1 培养基、稀释剂 pH7.0氯化钠-蛋白胨缓冲液、胰酪大豆胨液体培养基(TSB)、胰酪大豆胨琼脂培养基、沙氏葡萄糖琼脂培养基、沙氏葡萄糖液体培养基、麦康凯琼脂培养基、麦康凯液体培养基、肠道增菌液体培养基、紫红胆盐葡萄糖琼脂培养基、RV沙门增菌液体培养基、木糖赖氨酸脱氧胆酸盐琼脂培养基 。均购于北京陆桥技术有限责任公司,以上培养基均通过了适用性和灵敏度检查。
1.2.2 菌种 白色念珠菌[CMCC(F)98001]、枯草芽孢杆菌[CMCC(B)63501]、黑曲霉[CMCC(F)98003]、铜绿假单胞菌[CMCC(B)10104]、金黄色葡萄球菌[CMCC(B)26003]、大肠埃希菌[CMCC(B)44102]、 乙型副伤寒沙门菌[CMCC( B) 50094],均为不超过5代的药典规定的试验菌株且购自中国食品药品检定研究院。
1.2.3 样品 活络镇痛片(津药达仁堂集团股份有限公司隆顺榕制药厂 规格为0.61g)
2 方法与结果
2.1 方法
2.1.1 菌液的制备
按照《中国药典》2020年版(四部)通则1105、1106项下方法制备菌液[2]。
2.1.2 供试液的制备
取活络镇痛片样品10g,加入100mLTSB中,振荡混匀,制成1∶10的供试液。取 1∶ 10供试液2 ml,加入TSB 8 ml中,振荡混匀,得到 1∶50 供试液。取 1∶ 10供试液1ml,加入TSB9 ml中,振荡混匀,得到 1∶100 供试液。[3]
2.1.3 需氧菌总数、霉菌和酵母菌总数计数方法适用性试验
(1)试验组:常规法 取1:10供试液 9.9 mL,每批5份,每份加入铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念球菌及黑曲霉的菌液0.1mL,[3]使供试液每1mL含菌量不大于100 CFU。充分混匀,吸取1mL,分别注入平皿中,倾注胰酪大豆胨琼脂培养基,每份平行制备2个平板,33.0℃ 培养3d,测定需氧菌总数。取1:10供试液9.9 mL,每批2份,每份加入白色念珠菌、黑曲霉菌液0.1 mL,使供试液每1mL含菌量不大于100 CFU。充分混匀,吸取 1mL注入平皿中,倾注沙氏葡萄糖琼脂培养基,每份平行制备2个平板,23.0℃ 培养5d,测定霉菌及酵母菌总数。稀释法:分别取“2.1.2”项下的 1∶ 50和1:100供试液 ,按上述方法操作。中和剂法:取本品10g,加含5%聚山梨酯80的胰酪大豆胨液体培养基稀释至100ml,置 45℃水浴中,振摇,制成1:10供试液,按上述方法操作。
(2)菌液组:用TSB代替供试液,同试验组操作。(3)供试品组:取“2.1.2”项下的 1 ∶10 供试液 1 ml,注入平皿中,立即倾注相应的培养基,培养条件条件同实验组,测定样品中的需氧菌总数、霉菌及酵母菌总数。(4)中和剂对照组:取含5%聚山梨酯80的胰酪大豆胨液体培养基代替供试品同试验组操作。
2.1.4控制菌检查方法的验证
2.1.4.1 耐胆盐革兰阴性菌
(1)试验组:取1:10供试液10ml两份,分别加入规定量大肠埃希菌和铜绿假单胞菌(均不大于100cfu),23.0℃培养2小时。取经预培养2小时的供试液用肠道菌增菌液体培养基10倍稀释至1:100和1:1000的供试液,取上述3个稀释级的供试液各1ml分别接种至10ml肠道菌增菌液体培养基中,33.0℃培养24小时。(2)阳性对照组:取TSB9.9ml两份,分别加入规定量大肠埃希菌和铜绿假单胞菌(均不大于100cfu),同试验组稀释培养。依相应检查法进行适用性检查。(3)实验结果:阳性对照组检出大肠埃希菌和铜绿假单胞菌;试验组检出大肠埃希菌和铜绿假单胞菌。方法适用性试验结果符合要求。
2.1.4.2 大肠埃希菌
(1)试验组:取1:10的供试液10ml和不大于100cfu大肠埃希菌悬液,加入100mlTSB中,33.0℃培养18小时。(2)阳性对照组:取规定量大肠埃希菌悬液(不大于100cfu),加入100mlTSB中,同试验组稀释培养。依相应检查法进行适用性检查。(3)实验结果:阳性对照组与试验组均检出大肠埃希菌,方法适用性试验结果符合要求。
2.1.4.3沙门菌
(1)试验组:取本品10g和规定量沙门菌(不大于100cfu)加入100ml的胰酪大豆胨液体培养基中,33.0℃培养18小时。(2)阳性对照组:取规定量沙门菌(不大于100cfu)加入100ml的胰酪大豆胨液体培养基中,同试验组稀释培养。依相应检查法进行适用性检查。(3)实验结果:试验组与阳性对照组均检出沙门菌。方法适用性试验结果符合要求。
2.2 回收率测定结果 回收比值 = [(试验组平均菌落数 -供试品组平均菌落数) / 阳性对照组平均菌落数] 。 按《中 国药 典》 2020 年版四部“1105、1106、1107”项下 规定进行结果判断,回收率比值应在 0.5 ~2 之间。
验证结果显示:常规法1∶10供试液需氧菌总数测定,枯草芽孢杆菌回收率比值均为 0,其他各菌回收率比值均达到试验要求,1:50、1∶100 供试液需氧菌总数枯草芽孢杆菌回收比值分别为 0.1和0.3,回收比值也未达到试验要求 ;试验结果如表1-2 所示,采用 1∶10 供试液(含5%聚山梨酯),需氧菌总数枯草芽孢杆菌回收比值达到试验要求,其他各菌回收率比值均达到试验要求。1∶10 供试液(含5%聚山梨酯)霉菌和酵母菌总数测定,两种菌回收率均达到试验要求。控制菌检查结果均有菌生长,菌落形态符合相应菌落特征。[4]
三批试验的需氧菌总数、霉菌和酵母菌总数计数方法适用性检测的回收比值见表 3,控制菌的方法学适用性试验结果如表 4 - 6 所示。[5]
表1需氧菌总数、霉菌和酵母菌总数常规方法回收比值
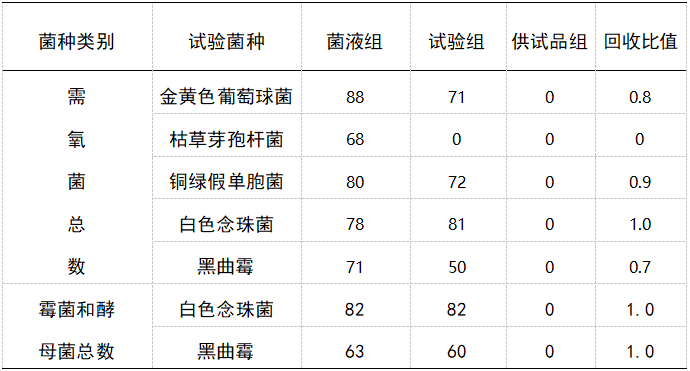
表 2 供试液稀释法需氧菌总数回收比值
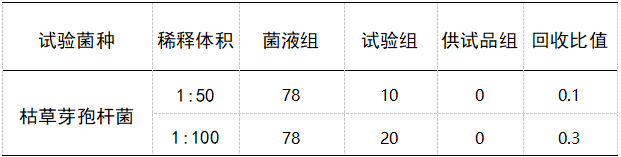
表 3 1:10(含5%聚山梨酯)供试液需氧菌总数回收比值
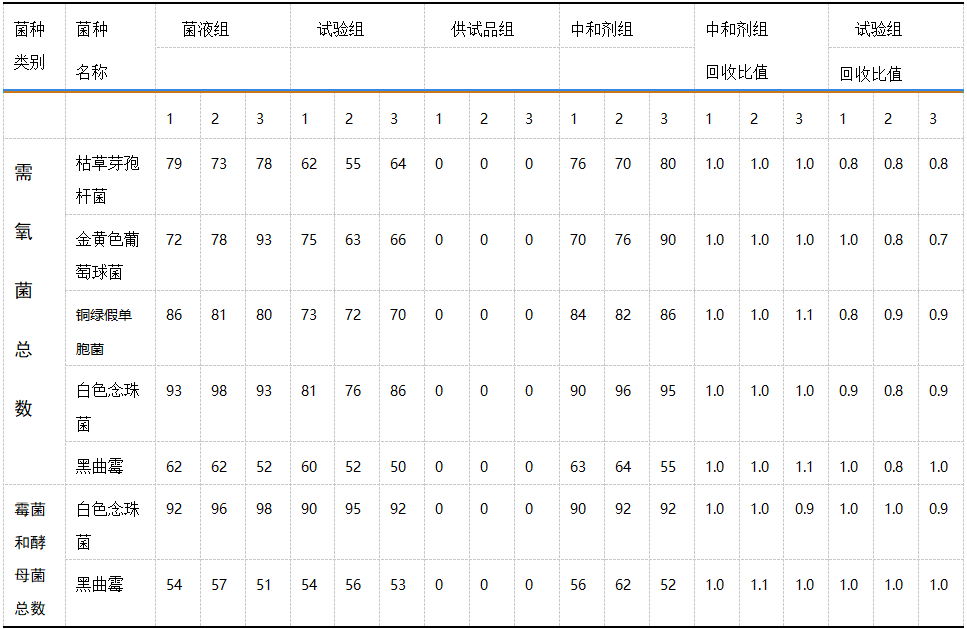
表4耐胆盐革兰阴性菌方法学适用性试验结果
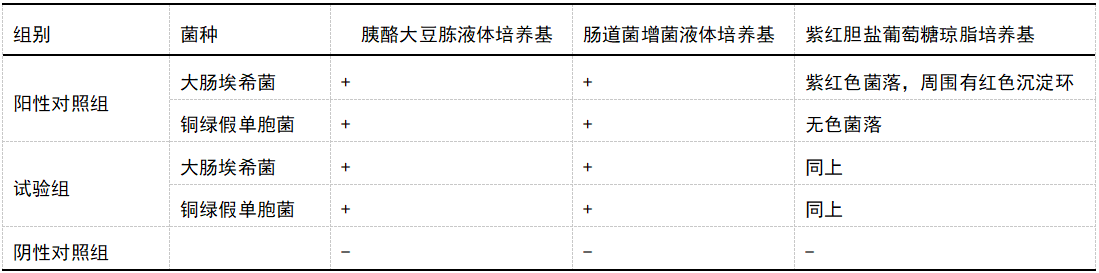
表5大肠埃希菌试验结果
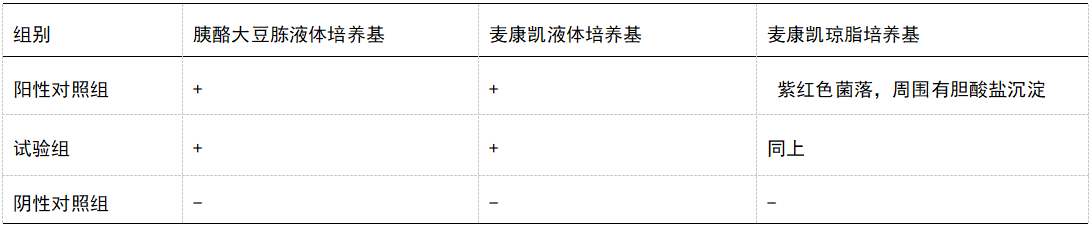
表6沙门菌方法学适用性试验结果
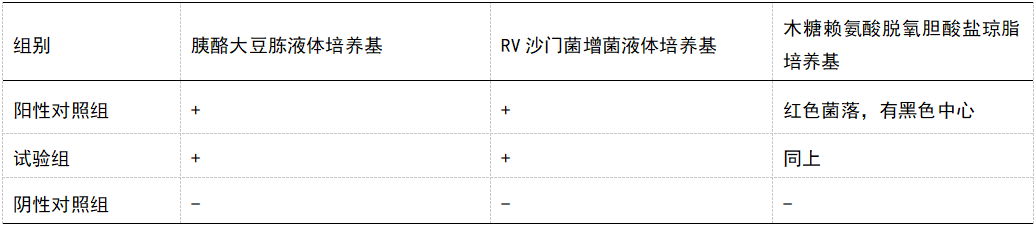
2.3活络镇痛片微生物限度检查结果及分析
根据《中国药典》 2020 年版四部通则 1105 规定,3批次样品回收比值均在 0. 5 ~ 2 范围内,可认为该供试品的制备方法和计数方法适用于该样品的菌落计数。控制菌试验组均检出试验菌,阴性对照无菌生长,可采用常规法检查。
3讨论
依照《中华人民共和国药典》2020 年版四部的规定:在微生物限度检查时,需要判断供试品对试验菌种是否有抗菌活性,如有则要选择合适的方法先消除或中和其抗菌活性再进行检查,以保证方法的适用性。结果显示,活络镇痛片对细菌具有一定的抑制作用,1:10、1:50和1:100供试液需氧菌总数枯草芽孢杆菌的回收比值均低于0.5,聚山梨酯80对药品抑菌性的中和作用,多有报道及阐述,[6]含5%聚山梨酯80的胰酪大豆胨液体培养基制备1∶ 10 供试液可中和抑菌性。采用三批样品进行重复试验,保证了检查方法的科学有效。药品微生物限度检查是保证用药的有效性、保障药品安全性的重要措施[7]。针对活络镇痛片微生物限度检查的试验方法,精准消除一些干扰因素,使操作简捷,结果精确,提高药品的检测质量,为相似药品微生物限度检查方法适用性试验提供参考。
参考文献
[1]国家药典委员会. 中华人民共和国国药典. 四部[M]. 北京: 中国医药科技出版社, 2020: 160-170
[2]解 慧,郭福庆,补肾强身片微生物限度检查方法研究及质量分析 [J]天津药学 2018,30 (1)14-19.
[3]中国食品药品检定研究院.中国药品检验标准操作规范[M].北京:中国医药科技出版社,2019:444-447.
[4]黄燕,戴余雯,周素琴等.赤芍桃仁颗粒微生物限度检查方法适用性试验研究.甘肃医药 2021,40( 7)635-638
[5]王洪家.解毒散结颗粒《中国药典》2015 年版微生物限度检查方法学验证[J].天津药学,2016,06(4).17-19.
[6]廖祥茹, 陈晨 ,李旸 ,陈鹰.聚山梨酯 80 在微生物限度检查中的应用.中国药师 2014, 17 (10).1776-1777
[7]胡昌勤.药品微生物控制体系建设现状与展望[J].中国现代应用药学,2021,38(5):513-519.





