肺癌是世界上公认的癌症相关性死亡的首要原因[1],近年来,随着分子靶向等治疗的逐步发展,患者的5年生存率大大地提高,但是,仍未完全得到控制[2]。尽管在现阶段中我们可以采取手术与放化疗等手段对肺癌病患进行治疗,但是,依旧未能有效解决肿瘤转移与复发的问题[3]。相关资料显示,免疫功能缺陷是肿瘤较高复发率与转移的重要诱发因素。肿瘤细胞免疫治疗是肺癌辅助治疗手段之一,随着免疫细胞的应用,也发现一些副反应[4]。细胞因子诱导杀伤细胞的作用机制,通过细胞表面的受体和肿瘤表面的配体结合后,免疫细胞释放穿孔素和细胞毒颗粒,这些颗粒能够直接穿透封闭的靶细胞进行胞吐,从而导致细胞的裂解[5]。本文着重分析于2017年6月-2020年5月在河北医科大学第四医院肿瘤科(免疫)接受细胞因子诱导杀伤细胞治疗的30例肺癌合并心功能不全患者的效果,现在把结果总结如下。
1 对象和方法
1.1 研究对象
河北医科大学第四医院肿瘤科(免疫)于2017年6月-2020年5月选出接受CIK细胞治疗的肺癌患者30例。纳入标准:①病人的临床资料均获得本院伦理委员会的审核与批准;②病人或(及)其家人对此研究一律知情研究;③病人的语言能力、理解能力等均正常,且具有较高的治疗依从性;排除标准:①将合并严重血液性疾病、传染性疾病病人排除;②将合并严重肝功能障碍、脑功能障碍、肾功能障碍的病人排除;③将精神疾病病人排除;④将中途撤出本次研究的病人排除。其中,男性患者16例,女性患者14例,年龄为45~75岁,平均年龄为(60.58±11.83)岁。采用美国纽约心脏病学会(NYHA)分级方案,把肺癌患者分为:心功能Ⅰ级组11人;Ⅱ级组9人;Ⅲ级组8人;Ⅳ级组2人。
1.2 实验试剂
IL-2、IL-6、IL-8、IL-10、TNF-α试剂均是购自易科拜得公司产品,应用酶联免疫吸附剂测定(ELISA)。
1.3 实验过程
在CIK治疗前及治疗后的24-48h,抽取患者的外周血并分离出血清,标准品按照说明书稀释5个梯度,各个梯度每孔加样量为50μL;分别设置空白孔、待测样品孔。在酶标包被板上待测样品孔先加样品稀释40μL,然后再加测样品10μL.加样将样品加于酶标版孔底部,尽量不触及到孔壁,轻轻晃动混匀;应用封板膜封板后置37℃温育30min;将30(48T的20倍)倍的浓缩洗涤液应用蒸馏水进行30(48T的20倍)倍的稀释后备用;小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静止30sec后弃去,如此重复5次,拍干;每孔加入酶标试剂50μL,再加入显色剂B50μL,轻轻震荡混匀,37℃避光显色15min;每孔加终止液50μL,终止反应;以空白空调零,450nm波长依序测量各孔的吸光度(OD值),测定应在加终止液后的15min内进行;以标准物浓度为坐标,OD值为横坐标,计算出标准曲线的多项式二次回归方程,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
1.4 监测项目
在入院后以及治疗后的24-48h,测定IL-2、IL-6、IL-8、IL-10、TNF-α与BNP等指标,并仔细观察患者在接受CIK治疗过程中心功能不全的变化情况。
1.5 心功能评价
在第一次CIK治疗后的24~48h,参照NYHA分级方案给予心功能评估:Ⅰ级:体力活动不受限,日常活动不引起过度乏力与呼吸困难等。Ⅱ级:体力活动轻度受限,休息时无症状,日常活动即可引起乏力或是心绞痛。Ⅲ级:体力活动明显受限,休息时无症状,轻于日常活动即可引起上述症状。Ⅳ级:不能从事任何体力活动,休息时亦有充血性心衰或是心绞痛症状,任何体力活动后加重[6]。
1.6 统计学方法
数据以统计学软件SPSS 20.0分析,以()表示计量资料,经t检验;以[n(%)]表示计数资料,经χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 相关指标分析
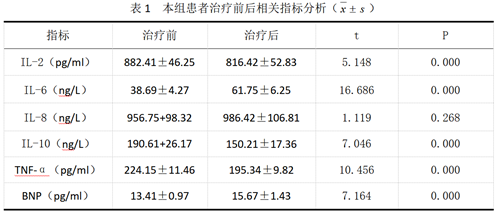
治疗前,本组的IL-2、IL-6、IL-8、IL-10、TNF-α、BNP依次是(882.41±46.25)pg/ml、(38.69±4.27)ng/L、(956.75+98.32)ng/L、(190.61+26.17)ng/L、(224.15±11.46)pg/ml、(13.41±0.97)pg/ml。治疗后IL-2、IL-6、IL-8、IL-10、TNF-α、BNP分别是(816.42±52.83)pg/ml、(61.75±6.25)ng/L、(986.42±106.81)ng/L、(150.21±17.36)ng/L、(195.34±9.82)pg/ml、(15.67±1.43)pg/ml。治疗后IL-8数值明显高于治疗前,IL-10下降较为明显,P<0.05。心功能Ⅲ、Ⅳ级BNP在CIK治疗后数值增加明显。具体见表1。
2.2 心功能分析
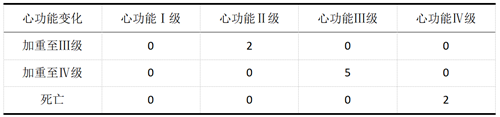
心功能Ⅰ级组CIK治疗后心功能无变化,心功能Ⅱ级组CIK治疗后有2人心功能加重并达到心功能Ⅲ标准,心功能Ⅲ级组CIK治疗后有5人心功能加重并达到Ⅳ标准,心功能Ⅳ级中有2例死亡。具体见表2。
表2 各组患者治疗后心功能分析(n,%)
3 讨论
细胞因子诱导杀伤细胞一直被认为是副作用较小、安全的肿瘤治疗手段之一,可以应用于一般状况欠佳且不能耐受手术与放化疗的患者[7]。本次研究发现,CIK治疗肺癌合并心功能不全患者具有相应的适应症与禁忌症。相关研究证实,心衰与各种炎性因子有关,炎性细胞因子在体内高度表达可以加重心肌损伤,使心功能恶化[8]。IL-6在心衰中的机制为:促进血管内皮细胞和血管平滑肌增生,形成恶性循环,加重病情,并于最终引发CHF[9]。TNF-α对心衰的作用机制为:降低心肌收缩力;诱发心室重构;促发心肌细胞凋亡;降低运动耐力;促进心衰恶病质[10]。IL-8在慢性心衰中表达增加,可以通过影响心肌细胞功能参与慢性心衰的发生与发展,并随心衰的加重而升高,对心房结构的重塑与心衰严重性等具有干预作用[11]。IL-10乃抗炎症细胞因子,其可以抑制炎症细胞因子的过度激活,以减轻心衰[12]。本次研究发现,在CIK治疗后IL-10明显下降,IL-10是抗炎症细胞因子,与心功能间呈负相关。IL-8在CIK治疗后明显升高,这极有可能是CIK治疗后心衰加重的主要原因。提示,心功能Ⅰ级、Ⅱ级均可以耐受CIK治疗,心功能Ⅲ级部分患者可加重,部分转为心功能Ⅳ级,是相对禁忌症。心功能Ⅳ级CIK治疗后可导致死亡,是绝对禁忌症。
综上所述,临床中在进行CIK治疗以前,需要更为详细地对患者进行心功能评估,不要盲目地对患者给予治疗。
参考文献
1、Waiker S.Updates in non-small cell lung cancer[J].Clinj Oncol Nurs,2008,12(4):587-596.
2、Klefstrom J, Vastrik I, saksela E,et al C-myc induces cellular susccptibility to the oytotoxic action of TNF-aIpha [J].EMBO J, 1994;13:5442-50.
3、刘俊恒.白细胞介素6受体研究进展[J].国外医学免疫学分册,1999,22(2):108.
4、李军,潘兴寿,黄照河,特发性房颤心力衰竭患者血清TNF、IL-6和IL-8表达的临床意义[J].广西医学,2006,8(28):1200.
5、丁国梁,张金超,王丹红,等,自体树突细胞联合细胞因子诱导的杀伤细胞治疗晚期非小细胞肺癌的临床研究[J].解放军医学杂志,2017,42(9):799-804.
6、刘懿萱,胡焕焕,姬国杰,等,大体系冻存对细胞因子诱导的杀伤细胞免疫表型及细胞杀伤活性的影响细胞内Ca2+水平的影响[J].新乡医学院学报,2017,(08):667-670.
7、宿敬存,赵卫,胡继红,等,TACE联合RFA及自体细胞因子诱导的杀伤细胞肝动脉灌注治疗原发性肝癌的临床研究[J].介入放射学杂志,2017,26(1):24-29.
8、刘波,陈伟,邓全红,自体细胞因子诱导的杀伤细胞回输对肾细胞癌根治术后患者T淋巴细胞亚群的影响[J].中国临床医生杂志,2017,45(9):54-56.
9、谭剑峰,钟承华,陈俊,等,负载肿瘤细胞裂解物的髓样与浆细胞样树突状细胞复合疫苗体外抗肺癌效应研究[J].中华肿瘤杂志,2019,41(7):501-507.
10、张宏,袁晔,沈诚,等,树突状细胞共培养细胞因子诱导的杀伤细胞联合培美曲塞或吉西他滨单药化疗治疗老年NSCLC的疗效和安全性[J].临床和实验医学杂志,2017,16(11):1107-1110.
11、姚冰清,贾原,郭继强,等,盐酸埃克替尼和细胞因子诱导的杀伤细胞对肺腺癌细胞的体外杀伤作用研究[J].中华肿瘤杂志,2017,39(08):573-578.
12、周美玉,许国发,王泽新,等,细胞因子诱导的杀伤细胞联合化疗对肺癌患者免疫功能及B7-H4蛋白表达的影响[J].山西医药杂志,2017,46(2):185-188.