Chronic Obstructive Pulmonary Disease (COPD) represents one of the most preva lent chronic respiratory disorders, imposing a significant burden on public health. Conventional therapeutic strategies, such as bronchodilators and inhaled corticosteroids, primarily focus on symptom management and the prevention of acute exacerbations. However, these treatments do not reverse disease progression or directly target the core pathological mechanisms, including chronic inflammation and immune dysregulation. In contrast, immune checkpoint inhibitors (ICIs), such as PD-1/PD-L1 inhibitors, have emerged as revolutionary tools in cancer immunotherapy. Their unique immunomodulatory potential raises the question of whether they could represent a novel direction for COPD treatment research. This review explores the potential of applying immune checkpoint inhibitors in COPD therapy, along with the associated opportunities and challenges, aiming to provide valuable insights for the selection of therapeutic strategies for COPD patients.
【Keywords】 Chronic obstructive pulmonary disease;Immune checkpoint inhibitors;Treatment;PD-1;PD-L1;Review
慢性阻塞性肺病(COPD)是一项具有高度致死率和伤残率的全球性公共卫生挑战,目前已成为全球第三大死因[1,2]。尽管传统治疗方法(如支气管扩张剂、吸入性糖皮质激素和肺康复)在缓解症状、降低急性加重风险和改善生活质量方面取得了一定成效,但这些疗法仅仅是对症处理,无法逆转疾病进展和针对COPD病理机制的核心问题(如慢性炎症和免疫失衡)进行根本干预,且长期使用可能引发感染风险和激素抵抗[3]。近年来,免疫学研究的迅速发展使人们认识到,COPD的慢性炎症不仅仅是免疫系统的过度活化,而是复杂的免疫失衡过程,包括免疫过度活化、免疫抑制、免疫耗竭和异常的炎症控制[4,5]。相较于传统治疗方法,免疫检查点抑制剂(ICIs)展现出独特优势。ICIs并非单纯的抗炎药物,它通过靶向PD-1/PD-L1等通路重新激活机体自身的免疫系统,恢复免疫细胞的活性和功能,纠正免疫细胞之间的失衡网络,从根源上改善患者的免疫内环境。本文就 COPD应用免疫检查点抑制剂的治疗进行综述,旨在为COPD患者的治疗方案选择提供有价值的参考,并对该领域目前存在的问题以及未来具有发展前景的研究方向进行了探讨。
1 COPD概述
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续的呼吸道症状和气流受限为主要特征的慢性气道炎症性疾病,通常呈进行性发展并与肺部对有害颗粒或气体的异常炎症反应有关[6]。COPD主要包括慢性支气管炎和肺气肿两种主要病理类型,常与长期吸烟或其他危险因素暴露有关[7]。COPD的发病过程缓慢,病程较长,初期可以没有自觉症状,但随着病程的发展,患者可出现慢性咳嗽、咳痰、气短或呼吸困难、喘息及胸闷等[8]。
2 COPD的流行病学特征
慢性阻塞性肺病(COPD)是目前最常见的慢性呼吸系统疾病,不仅对人类健康造成严重威胁,还显著降低了患者的生活质量。据估计,2015年全球约有1.75亿成年人患有慢阻肺,且这一数字从1990年至2015年间增长了44.2%[9]。在我国,2018年中国成人肺部健康研究调查结果显示,40岁及以上人群中慢阻肺患病率高达13.7%,总患病人数接近1亿[10]。根据2020年世界卫生组织公布的数据显示,慢阻肺是全球第三大死因,患病率约为全球成年人口的10%,2019年因COPD死亡的人数约为320万,占全球总死亡人数的6%,仅次于心脏病和脑卒中[11,12]。
3 目前COPD的治疗方法及其局限性
慢性阻塞性肺病(COPD)目前的治疗方案以症状管理为主,包括支气管扩张剂、吸入性糖皮质激素(ICS)、肺康复和氧疗等方法[13]。尽管传统的治疗方法能显著改善患者的症状和生活质量,但仍存在一定的局限性,如无法修复已经受损的肺组织或从根本上阻止疾病的进展,即使采用最佳的治疗策略,许多患者仍可能经历急性加重事件,从而对预后产生不利影响。据估计,每22%-40%的慢性阻塞性肺病患者至少经历一次中度或重度恶化,而9% -16%的人经历过不止一次[14,15],且一些药物可能会引发不良反应,多项研究表明,ICS的使用与口腔念珠菌感染风险显著增加有关,其中一项系统评价显示,ICS几乎使口腔念珠菌感染的风险增加了两倍[16],此外,长期使用ICS还可能增加肺炎的发生风险,尤其是在三联疗法中,Aggarwal等[17]的研究表明,采用包含ICS的三联疗法组的肺炎发生率为7.6%,而未使用ICS的对照组仅为4.7%。磷酸二酯酶-4抑制剂(PDE-4抑制剂)虽然在COPD治疗中表现出一定的疗效,但其可能引发胃肠道不良反应,如恶心、腹泻和食欲减退等[18]。对于终末期慢性阻塞性肺疾病(COPD)患者来说,当药物治疗效果有限时,外科干预如肺移植可作为一种潜在的治疗选择。然而,由于供体肺源的稀缺性以及手术的高风险性,肺移植手术的开展受到很大限制。每年全球仅有约1500例肺移植手术得以实施,且这些手术主要集中于病情最为危重的患者群体。此外,肺移植术后可能出现的并发症如实体器官排斥和慢性肺功能障碍也会影响患者的长期生存[19]。因此,探索新型治疗方案对降低疾病负担至关重要。
4 COPD中的免疫失衡
在COPD的病理生理机制中,免疫失衡是驱动慢性炎症和疾病进展的核心因素。这种免疫失衡包括免疫过度活化、免疫抑制、免疫耗竭和炎症控制异常。
(1)免疫过度活化:COPD患者体内存在多种炎症细胞的异常激活,如中性粒细胞、巨噬细胞、T淋巴细胞等。这些免疫细胞通过释放大量的炎症介质(如TNF-α、IL-6、IL-8、IFN-γ等)和蛋白酶(如弹性蛋白酶、基质金属蛋白酶等),导致肺组织的破坏和气道重塑[20]。此外,吸烟和空气污染等环境因素通过增加氧化应激水平,激活炎症信号通路(如NF-κB等),进一步加剧气道和肺部的炎症反应[21]。
(2)免疫抑制:COPD患者中辅助性T细胞1(Th1)与辅助性T细胞2(Th2)的平衡失调,表现为Th17细胞的过度表达和调节性T细胞(Tregs)的减少[22]。这种免疫失衡导致机体的免疫抑制功能减弱,使其对感染的抵抗力下降,从而加剧了疾病的进展。
(3)免疫耗竭:在COPD中,慢性炎症环境导致T细胞功能耗竭的现象与慢性病毒感染和肿瘤中的T细胞耗竭有相似之处。例如,在慢性病毒感染(如HIV、乙型肝炎病毒等)和肿瘤中,T细胞因长期暴露于抗原刺激而逐渐丧失效应功能,表现为程序性死亡受体-1(PD-1)等免疫抑制性受体的高表达[23]。此类耗竭状态的T细胞通常表现出效应功能减退、增殖能力下降以及细胞因子分泌减少等特征[24]。
(4)炎症控制异常:COPD的炎症控制异常主要表现为促炎因子(如TNF-α、IL-1β、IL-8等)的表达水平显著升高,而抗炎因子(如IL-10)的表达水平相对不足,导致炎症反应的负反馈调节机制失效[25]。这种促炎与抗炎因子的失衡加剧了炎症反应,使得炎症过程难以自我调节,从而加重了肺组织的破坏[26]。同时,巨噬细胞在COPD中的极化状态也发生了显著变化。巨噬细胞通常分为促炎性的M1型和抗炎性的M2型。在COPD中,巨噬细胞更倾向于向M1表型极化,而与组织修复相关的M2表型显著减少[27]。这种极化偏向导致更多的炎症介质释放,进一步加剧了肺部的炎症反应和组织损伤。
如图1,以上多重免疫失衡机制的协同作用推动了COPD的慢性炎症反应及病理生理进展。
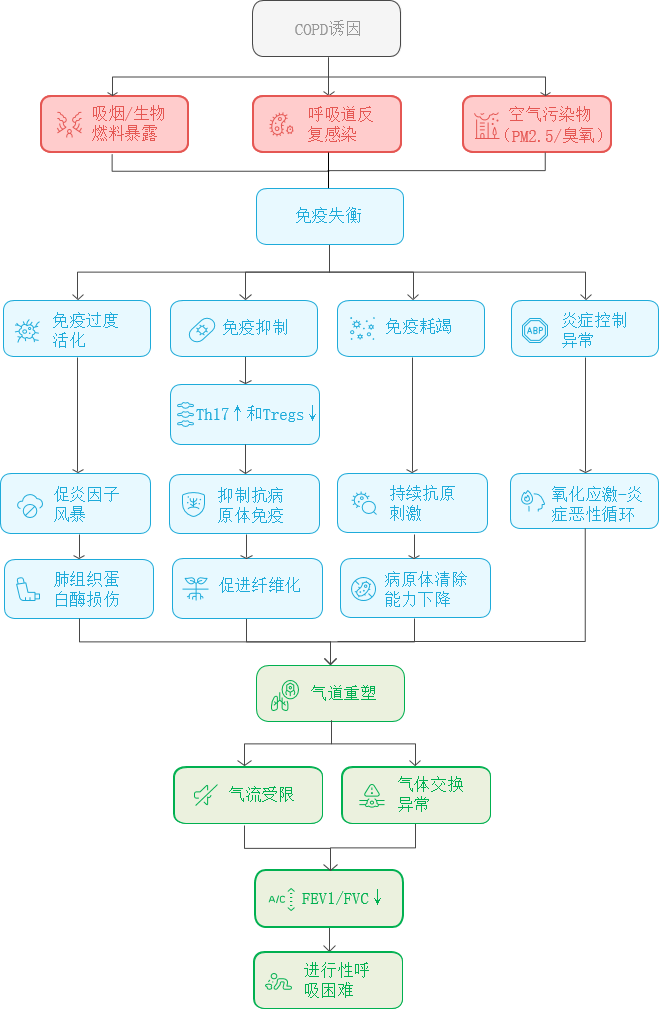
图1 COPD免疫失衡病理机制图
5 免疫检查点及其机制
免疫检查点(Immune Checkpoints)是免疫系统中一组重要的调控分子,主要通过抑制过度的免疫反应来维持机体的免疫稳态,从而防止自身免疫性疾病的发生。在生理状态下,这些分子发挥着重要的保护性作用;然而,在病理条件下(如肿瘤或慢性炎症),它们可能被异常利用,导致免疫逃逸或免疫调节失衡。
5.1 PD-1/PD-L1通路在免疫调控中的关键作用
PD-1(程序性死亡受体-1)是一种关键的免疫抑制性受体,广泛表达于多种免疫细胞表面,包括T细胞、B细胞、自然杀伤细胞(NK细胞)、巨噬细胞和树突状细胞等,其配体PD-L1主要表达于肿瘤细胞表面,同时也存在于抗原呈递细胞(APCs)、树突状细胞和巨噬细胞等免疫细胞上。PD-L2则主要在巨噬细胞、树突状细胞和肥大细胞等细胞中表达[28]。当PD-1与其配体PD-L1结合后,能够抑制T细胞的活性和增殖,从而发挥免疫抑制作用。这一信号通路在维持免疫耐受和防止免疫反应过度激活中起到了重要的负向调控作用[29,30]。在正常生理状态下,该通路通过PD-1与PD-L1的结合向T细胞传递抑制性信号,减少T细胞的增殖、细胞毒性和细胞因子分泌,从而抑制过度的免疫反应,防止自身免疫疾病的发生以及对正常组织的炎症损伤。然而,在某些病理状态下,该通路可能被异常激活。例如,在肿瘤微环境中,肿瘤细胞可通过高表达PD-L1等配体与T细胞表面的PD-1结合,抑制T细胞的活性,从而实现免疫逃逸,逃避免疫系统的监视和清除[31,32]。类似地,研究发现,COPD患者的气道和肺组织中存在PD-1高表达的T细胞,尤其是在CD4+T细胞和调节性T细胞(Tregs)中。这种PD-1的过度表达导致T细胞功能耗竭,削弱了免疫系统对病原体和炎症细胞的清除能力,从而加剧了气道炎症和组织损伤。此外,COPD患者的巨噬细胞和树突状细胞中PD-L1的表达水平降低,导致PD-L1与PD-1结合后通过负向调节信号抑制T细胞活性的能力减弱,进一步削弱了免疫系统的功能,加重了病情[33,34]。
6 免疫检查点抑制剂(ICIs)的发展
免疫检查点抑制剂(immune checkpoint inhibitors)是一类通过靶向抑制免疫检查点分子的活性以解除T细胞功能抑制的药物,显著提升了多种恶性肿瘤的治疗效果[35]。目前,针对PD-1、PD-L1和CTLA-4的单克隆抗体已获批用于治疗多种癌症,包括黑色素瘤、非小细胞肺癌、肾细胞癌和膀胱癌等。这些药物通过阻断PD-1与PD-L1或其配体之间的相互作用,恢复T细胞的抗肿瘤活性,从而有效抑制肿瘤生长[36,37]。许多接受ICIs治疗的晚期肿瘤患者实现了长期无病生存,甚至达到完全缓解[38,39]。此外,ICIs在一些慢性炎症性疾病中也展现出潜在的治疗前景。
6.1 在COPD中应用免疫检查点抑制剂可能的机制
免疫检查点抑制剂(ICIs)在慢性阻塞性肺病(COPD)中的应用研究基于COPD的慢性炎症和免疫失衡特征,其病理生理过程包括免疫过度活化、免疫抑制和T细胞耗竭等,这些特征为ICIs的潜在治疗作用提供了理论依据。通过阻断免疫检查点信号通路,解除免疫抑制并恢复T细胞的效应功能,ICIs可能在缓解COPD的慢性炎症反应和延缓疾病进展中发挥重要作用。
ICIs通过阻断PD-1/PD-L1信号通路,能够恢复T细胞的功能。COPD患者的慢性炎症环境常导致T细胞耗竭,表现为细胞毒性降低、增殖能力减弱以及细胞因子分泌不足。这种耗竭状态与PD-1高表达密切相关,表明PD-1/PD-L1通路在COPD的免疫失衡中起重要作用。研究表明,阻断PD-1/PD-L1信号通路可恢复T细胞的增殖能力和效应功能,增强其清除炎症细胞和病原体的能力。这一机制在多种疾病背景下得到验证,包括慢性感染、肿瘤以及自身免疫性疾病[40–42]。这不仅有助于增强患者对细菌和病毒的免疫应答能力,还能减少慢性感染和急性加重的风险。
ICIs可能通过减轻慢性炎症对COPD的病理过程产生积极影响。COPD患者气道中存在大量活化的免疫细胞,包括中性粒细胞、巨噬细胞和T细胞,这些细胞释放促炎因子(如TNF-α、IL-6、IL-8),加剧炎症反应和组织损伤。同时,免疫抑制状态削弱了炎症反应的调控能力,导致炎症持续存在。ICIs可以通过阻断PD-1/PD-L1信号通路的抑制作用,激活T细胞并促进其释放抗炎因子,从而平衡炎症反应,恢复免疫系统对炎症的负反馈调节能力,减少慢性炎症及其导致的气道重塑及组织损伤。这一机制有助于缓解COPD患者的气道炎症和肺功能下降,从而改善疾病预后。
ICIs在改善免疫调控失衡方面同样具有潜在作用。COPD患者气道中PD-1和PD-L1的表达水平升高,抑制了T细胞对病原体和炎症细胞的清除能力。同时,研究显示,巨噬细胞极化失衡是多种肺部疾病的重要病理特征。M1型巨噬细胞主要通过分泌促炎因子(如IL-1β、IL-6、TNF-α、IL-12)促进炎症反应,在COPD患者中,M1型巨噬细胞的浸润与炎症标志物(如CRP)水平升高直接相关[43],而M2型巨噬细胞则通过分泌抗炎因子(如IL-10、TGF-β)参与组织修复和重塑。这种失衡导致炎症过度或修复不足,进一步加剧了组织损伤和气道重塑[44,45]。通过阻断PD-1/PD-L1信号通路,ICIs可能通过影响免疫细胞的信号通路,间接调节巨噬细胞的极化状态,促进巨噬细胞向M2型极化,从而发挥抗炎作用并促进肺组织修复,但目前尚无临床样本分析和类器官模型验证表明此机制,未来需进一步探索。
ICIs可能通过减少促炎因子的释放,减轻气道上皮和肺泡壁的损伤,从而间接抑制气道重塑的发展并改善肺功能。研究表明,COPD患者体内存在显著的系统性炎症,这种炎症不仅局限于肺部,还累及全身多个系统,包括骨骼肌、心血管系统和代谢系统等[46,47]。COPD的系统性炎症也可通过ICIs的免疫调节作用得到缓解,有助于减轻COPD相关的全身性炎症及其并发症。
ICIs在治疗非小细胞肺癌(NSCLC)及肺癌合并慢性阻塞性肺病(LC-COPD)的患者中可能发挥双重作用。一方面,ICIs在肺癌治疗中已经展现出显著的疗效,尤其是在驱动基因阴性的NSCLC患者中,能够显著延长生存期和无进展生存期[48]。另一方面,COPD患者作为肺癌的高危人群,其慢性炎症微环境和免疫功能障碍可能为肿瘤的发生和发展提供有利条件[49]。在COPD合并肺癌的患者中,ICIs不仅可能抑制肿瘤的生长,还可能通过改善COPD的慢性炎症和免疫功能为患者带来额外获益。如表1[50–53]所示,接受ICIs治疗的LC-COPD患者在OS、PFS和肺功能方面有所改善,这表明ICIs可能对COPD患者的慢性炎症和免疫功能有积极影响。
表1 有无合并COPD的肺癌患者经ICIs治疗后结果对比
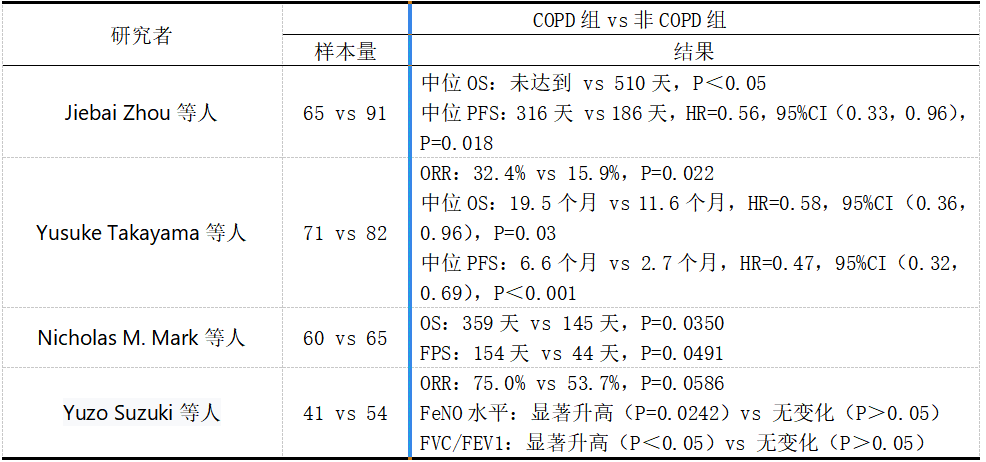
OS:总生存期,PFS:无进展生存期,ORR:客观缓解率,FeNO:一氧化氮呼气试验,FEV1:一秒用力呼气量,FVC:用力肺活量
通过靶向PD-1/PD-L1通路调节免疫失衡,从根源上干预COPD的慢性炎症和免疫耗竭,利用ICIs在双重病理中的潜在协同作用,为个性化治疗提供了新思路。
7 挑战与前望
尽管免疫检查点抑制剂(ICIs)在COPD治疗中展现出潜力,但其临床应用仍面临诸多挑战。一方面,COPD的慢性炎症是其核心病理特征,但适度的炎症反应也有助于抗感染和组织修复。过度激活免疫系统可能导致炎症反应失控,从而加重肺部损伤。另一方面,ICIs可能引发免疫相关不良反应(如免疫相关性肺炎、结肠炎等),尤其是在肺功能已受损的COPD患者中,这一风险需要特别关注[54]。此外,COPD患者的病理机制复杂多样,不同亚型(如炎症型、免疫耗竭型)的患者对ICIs的反应可能存在显著差异,因此如何筛选出适合ICIs治疗的亚群患者仍需深入研究[55]。同时,COPD作为一种慢性疾病,需要长期治疗,而ICIs的长期疗效及其潜在的耐药性问题尚未完全明确,仍需进一步研究以评估其持续疗效。目前,针对ICIs在COPD治疗中的大规模、高质量随机对照临床试验仍然缺乏,这限制了对ICIs临床价值的全面评估。因此,在推进ICIs用于COPD治疗的过程中,需要进一步解决这些问题,以确保其疗效和安全性。尽管这一领域的研究尚处于早期阶段,但免疫检查点抑制剂凭借其精准的免疫调节机制,作为COPD治疗的新型策略,有望为全球数百万COPD患者带来新的治疗希望。
8 结论
免疫检查点抑制剂(ICIs)为COPD的治疗提供了全新的研究方向,其通过恢复T细胞活性、减少慢性炎症以及改善免疫失衡等多重机制,展现出良好的潜在疗效。目前,研究主要集中在COPD合并肺癌患者以及临床前动物模型中,但早期数据已表明其在缓解炎症和改善肺功能方面具有积极作用。未来需进一步开展大规模临床试验,以评估ICIs在COPD不同亚型中的疗效与安全性,并探索联合治疗方案,以最大化其治疗潜力。尽管在技术和应用上仍面临诸多挑战,但ICIs有望成为慢性阻塞性肺病个性化治疗的重要组成部分,为患者带来更好的生存和生活质量。
参考文献
[1] LABAKI W W, ROSENBERG S R. Chronic Obstructive Pulmonary Disease[J/OL]. Annals of Internal Medicine, 2020, 173(3): ITC17-ITC32. DOI:10.7326/AITC202008040.
[2] ADELOYE D, CHUA S, LEE C, 等. Global and regional estimates of COPD prevalence: Systematic review and meta–analysis[J/OL]. Journal of Global Health, 2015, 5(2): 020415. DOI:10.7189/jogh.05.020415.
[3] AREZINA R, CHEN T, WANG D. Conventional, Complementary and Alternative Medicines: Mechanistic Insights into Therapeutic Landscape of Chronic Obstructive Pulmonary Disease[J/OL]. International Journal of Chronic Obstructive Pulmonary Disease, 2023, Volume 18: 447-457. DOI:10.2147/COPD.S393540.
[4] MARK N M, KARGL J, BUSCH S E, 等. Chronic Obstructive Pulmonary Disease Alters Immune Cell Composition and Immune Checkpoint Inhibitor Efficacy in Non–Small Cell Lung Cancer[J/OL]. American Journal of Respiratory and Critical Care Medicine, 2018, 197(3): 325-336. DOI:10.1164/rccm.201704-0795OC.
[5] SHIN S H, PARK H Y, IM Y, 等. Improved treatment outcome of pembrolizumab in patients with nonsmall cell lung cancer and chronic obstructive pulmonary disease[J/OL]. International Journal of Cancer, 2019, 145(9): 2433-2439. DOI:10.1002/ijc.32235.
[6] CHRISTENSON S A, SMITH B M, BAFADHEL M, 等. Chronic obstructive pulmonary disease[J/OL]. The Lancet, 2022, 399(10342): 2227-2242. DOI:10.1016/S0140-6736(22)00470-6.
[7] 慢性阻塞性肺疾病危险因素流行病学研究新进展[J]. 中华疾病控制杂志, 2014(10 vo 18): 998-1002.
[8] SORIANO J B, KENDRICK P J, PAULSON K R, 等. Prevalence and attributable health burden of chronic respiratory diseases, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017[J/OL]. The Lancet Respiratory Medicine, 2020, 8(6): 585-596. DOI:10.1016/S2213-2600(20)30105-3.
[9] VOS T, ALLEN C, ARORA M, 等. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015[J/OL]. The Lancet, 2016, 388(10053): 1545-1602. DOI:10.1016/S0140-6736(16)31678-6.
[10] WANG C, XU J, YANG L, 等. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health [CPH] study): a national cross-sectional study[J/OL]. The Lancet, 2018, 391(10131): 1706-1717. DOI:10.1016/S0140-6736(18)30841-9.
[11] SAFIRI S, CARSON-CHAHHOUD K, NOORI M, 等. Burden of chronic obstructive pulmonary disease and its attributable risk factors in 204 countries and territories, 1990-2019: results from the Global Burden of Disease Study 2019[J/OL]. BMJ, 2022: e069679. DOI:10.1136/bmj-2021-069679.
[12] AGUSTÍ A, CELLI B R, CRINER G J, 等. Global Initiative for Chronic Obstructive Lung Disease 2023 Report: GOLD Executive Summary[J/OL]. European Respiratory Journal, 2023, 61(4): 2300239. DOI:10.1183/13993003.00239-2023.
[13] 慢性阻塞性肺疾病诊治指南(2007年修订版)[J]. 中华结核和呼吸杂志, 2007(01 vo 30): 8-17 AB 前言慢性阻塞性肺疾病(COPD)由于其患病人数多,死亡率高,社会经济负担重,已成为一个重要的公共卫生问题。COPD 目前居全球死亡原因的第4位,世界银行/世界卫生组织公布,至2020年 COPD将位居世界疾病经济负担的第5位。在我国,COPD同样是严重危害人民身体健康的重要慢性呼吸系统.
[14] GAYLE A, DICKINSON S, MORRIS K, 等. What is the impact of GOLD 2017 recommendations in primary care? – a descriptive study of patient classifications, treatment burden and costs[J/OL]. International Journal of Chronic Obstructive Pulmonary Disease, 2018, Volume 13: 3485-3492. DOI:10.2147/COPD.S173664.
[15] HASTIE A T, MARTINEZ F J, CURTIS J L, 等. Association of sputum and blood eosinophil concentrations with clinical measures of COPD severity: an analysis of the SPIROMICS cohort[J/OL]. The Lancet Respiratory Medicine, 2017, 5(12): 956-967. DOI:10.1016/S2213-2600(17)30432-0.
[16] MIRAVITLLES M, AULADELL-RISPAU A, MONTEAGUDO M, 等. Systematic review on long-term adverse effects of inhaled corticosteroids in the treatment of COPD[J/OL]. European Respiratory Review, 2021, 30(160): 210075. DOI:10.1183/16000617.0075-2021.
[17] AGGARWAL B, JONES P, CASAS A, 等. Association between Increased Risk of Pneumonia with ICS in COPD: A Continuous Variable Analysis of Patient Factors from the IMPACT Study[J/OL]. Pulmonary Therapy, 2024, 10(2): 183-192. DOI:10.1007/s41030-024-00255-1.
[18] MARTIN C, BURGEL P R, ROCHE N. Inhaled Dual Phosphodiesterase 3/4 Inhibitors for the Treatment of Patients with COPD: A Short Review[J/OL]. International Journal of Chronic Obstructive Pulmonary Disease, 2021, Volume 16: 2363-2373. DOI:10.2147/COPD.S226688.
[19] VERLEDEN G M, GOTTLIEB J. Lung transplantation for COPD/pulmonary emphysema[J/OL]. European Respiratory Review, 2023, 32(167): 220116. DOI:10.1183/16000617.0116-2022.
[20] 田春燕, 张继红, 李伟国, 等. 细胞因子与COPD炎症机制研究进展[J]. 临床肺科杂志, 2011, 16(02): 248-249.
[21] CARVALHO J L, MIRANDA M, FIALHO A K, 等. Oral feeding with probiotic Lactobacillus rhamnosus attenuates cigarette smoke-induced COPD in C57Bl/6 mice: Relevance to inflammatory markers in human bronchial epithelial cells[J/OL]. PLOS ONE, 2020, 15(4): e0225560. DOI:10.1371/journal.pone.0225560.
[22] ZHAO P, LIU X, DONG H, 等. Bufei Yishen Formula Restores Th17/Treg Balance and Attenuates Chronic Obstructive Pulmonary Disease via Activation of the Adenosine 2a Receptor[J/OL]. Frontiers in Pharmacology, 2020, 11: 1212. DOI:10.3389/fphar.2020.01212.
[23] KIM P S, AHMED R. Features of responding T cells in cancer and chronic infection[J/OL]. Current Opinion in Immunology, 2010, 22(2): 223-230. DOI:10.1016/j.coi.2010.02.005.
[24] BOYERO L, SÁNCHEZ-GASTALDO A, ALONSO M, 等. Primary and Acquired Resistance to Immunotherapy in Lung Cancer: Unveiling the Mechanisms Underlying of Immune Checkpoint Blockade Therapy[J/OL]. Cancers, 2020, 12(12): 3729. DOI:10.3390/cancers12123729.
[25] DEWALD J, COLOMB F, BOBOWSKI-GERARD M, 等. Role of Cytokine-Induced Glycosylation Changes in Regulating Cell Interactions and Cell Signaling in Inflammatory Diseases and Cancer[J/OL]. Cells, 2016, 5(4): 43. DOI:10.3390/cells5040043.
[26] VITENBERGA Z, PILMANE M, BABJONIŠEVA A. An Insight into COPD Morphopathogenesis: Chronic Inflammation, Remodeling, and Antimicrobial Defense[J/OL]. Medicina, 2019, 55(8): 496. DOI:10.3390/medicina55080496.
[27] BU T, WANG L F, YIN Y Q. How Do Innate Immune Cells Contribute to Airway Remodeling in COPD Progression?[J/OL]. International Journal of Chronic Obstructive Pulmonary Disease, 2020, Volume 15: 107-116. DOI:10.2147/COPD.S235054.
[28] 王岳, 全纯涛, 吴红雅, 等. 程序性死亡配体PD-L1在肿瘤中调控机制的研究进展[J/OL]. 生命科学, 2023, 35(03): 367-377. DOI:10.13376/j.cbls/2023045.
[29] OKAZAKI T, HONJO T. PD-1 and PD-1 ligands: from discovery to clinical application[J/OL]. International Immunology, 2007, 19(7): 813-824. DOI:10.1093/intimm/dxm057.
[30] PIĘTAK P, PIETRZYK N, PAWŁOWSKA A, 等. [The meaning of PD-1/PD-L1 pathway in ovarian cancer pathogenesis][J]. Wiadomosci Lekarskie (Warsaw, Poland: 1960), 2018, 71(5): 1089-1094.
[31] PASSARDI A, CANALE M, VALGIUSTI M, 等. Immune Checkpoints as a Target for Colorectal Cancer Treatment[J/OL]. International Journal of Molecular Sciences, 2017, 18(6): 1324. DOI:10.3390/ijms18061324.
[32] RIELLA L V, PATERSON A M, SHARPE A H, 等. Role of the PD-1 Pathway in the Immune Response[J/OL]. American Journal of Transplantation, 2012, 12(10): 2575-2587. DOI:10.1111/j.1600-6143.2012.04224.x.
[33] ULIŃSKI R, KWIECIEŃ I, DOMAGAŁA-KULAWIK J. Lung Cancer in the Course of COPD-Emerging Problems Today[J/OL]. Cancers, 2022, 14(15): 3819. DOI:10.3390/cancers14153819.
[34] SUZUKI Y, INUI N, KARAYAMA M, 等. Effect of PD-1 inhibitor on exhaled nitric oxide and pulmonary function in non-small cell lung cancer patients with and without COPD[J/OL]. International Journal of Chronic Obstructive Pulmonary Disease, 2019, Volume 14: 1867-1877. DOI:10.2147/COPD.S214610.
[35] SAADI W, FATMI A, PALLARDÓ F V, 等. Long Non-Coding RNAs as Epigenetic Regulators of Immune Checkpoints in Cancer Immunity[J/OL]. Cancers, 2022, 15(1): 184. DOI:10.3390/cancers15010184.
[36] CHERA A, STANCU A L, BUCUR O. Thyroid-related adverse events induced by immune checkpoint inhibitors[J/OL]. Frontiers in Endocrinology, 2022, 13: 1010279. DOI:10.3389/fendo.2022.1010279.
[37] KONG Y, WANG X, QIE R. Immunotherapy-associated cardiovascular toxicities: insights from preclinical and clinical studies[J/OL]. Frontiers in Oncology, 2024, 14: 1347140. DOI:10.3389/fonc.2024.1347140.
[38] ROCCO D, DELLA GRAVARA L, RAGONE A, 等. Prognostic Factors in Advanced Non-Small Cell Lung Cancer Patients Treated with Immunotherapy[J/OL]. Cancers, 2023, 15(19): 4684. DOI:10.3390/cancers15194684.
[39] ZHANG T, WANG Y, SHI C, 等. Pancreatic injury following immune checkpoint inhibitors: A systematic review and meta-analysis[J/OL]. Frontiers in Pharmacology, 2022, 13: 955701. DOI:10.3389/fphar.2022.955701.
[40] SAEIDI A, ZANDI K, CHEOK Y Y, 等. T-Cell Exhaustion in Chronic Infections: Reversing the State of Exhaustion and Reinvigorating Optimal Protective Immune Responses[J/OL]. Frontiers in Immunology, 2018, 9: 2569. DOI:10.3389/fimmu.2018.02569.
[41] TRIANTAFYLLOU E, GUDD C L C, MAWHIN M A, 等. PD-1 blockade improves Kupffer cell bacterial clearance in acute liver injury[J/OL]. Journal of Clinical Investigation, 2021, 131(4): e140196. DOI:10.1172/JCI140196.
[42] MARRELLA V, FACOETTI A, CASSANI B. Cellular Senescence in Immunity against Infections[J/OL]. International Journal of Molecular Sciences, 2022, 23(19): 11845. DOI:10.3390/ijms231911845.
[43] HU T, PANG N, LI Z, 等. The Activation of M1 Macrophages is Associated with the JNK-m6A-p38 Axis in Chronic Obstructive Pulmonary Disease[J/OL]. International Journal of Chronic Obstructive Pulmonary Disease, 2023, Volume 18: 2195-2206. DOI:10.2147/COPD.S420471.
[44] YAO Y, WANG Y, ZHANG Z, 等. Chop Deficiency Protects Mice Against Bleomycin-induced Pulmonary Fibrosis by Attenuating M2 Macrophage Production[J/OL]. Molecular Therapy, 2016, 24(5): 915-925. DOI:10.1038/mt.2016.36.
[45] 李尹, 鲁静, 张毅, 等. 巨噬细胞极化及其在慢性阻塞性肺疾病中的作用[J/OL]. 生理学报, 2019, 71(04): 604-612. DOI:10.13294/j.aps.2019.0055.
[46] BARNES P J, CELLI B R. Systemic manifestations and comorbidities of COPD[J/OL]. European Respiratory Journal, 2009, 33(5): 1165-1185. DOI:10.1183/09031936.00128008.
[47] RENNARD S I. Inflammation in COPD: a link to systemic comorbidities[J/OL]. European Respiratory Review, 2007, 16(105): 91-97. DOI:10.1183/09059180.00010502.
[48] ZHOU C, QIN Y, ZHAO W, 等. International expert consensus on diagnosis and treatment of lung cancer complicated by chronic obstructive pulmonary disease[J/OL]. Translational Lung Cancer Research, 2023, 12(8): 1661-1701. DOI:10.21037/tlcr-23-339.
[49] QIAN S, GOLUBNITSCHAJA O, ZHAN X. Chronic inflammation: key player and biomarker-set to predict and prevent cancer development and progression based on individualized patient profiles[J/OL]. EPMA Journal, 2019, 10(4): 365-381. DOI:10.1007/s13167-019-00194-x.
[50] ZHOU J, CHAO Y, YAO D, 等. Impact of chronic obstructive pulmonary disease on immune checkpoint inhibitor efficacy in advanced lung cancer and the potential prognostic factors[J/OL]. Translational Lung Cancer Research, 2021, 10(5): 2148-2162. DOI:10.21037/tlcr-21-214.
[51] MARK N M, KARGL J, BUSCH S E, 等. Chronic Obstructive Pulmonary Disease Alters Immune Cell Composition and Immune Checkpoint Inhibitor Efficacy in Non–Small Cell Lung Cancer[J/OL]. American Journal of Respiratory and Critical Care Medicine, 2018, 197(3): 325-336. DOI:10.1164/rccm.201704-0795OC.
[52] TAKAYAMA Y, NAKAMURA T, FUKUSHIRO Y, 等. Coexistence of Emphysema With Non-small-cell Lung Cancer Predicts the Therapeutic Efficacy of Immune Checkpoint Inhibitors[J/OL]. In Vivo, 2021, 35(1): 467-474. DOI:10.21873/invivo.12280.
[53] SUZUKI Y, INUI N, KARAYAMA M, 等. Effect of PD-1 inhibitor on exhaled nitric oxide and pulmonary function in non-small cell lung cancer patients with and without COPD[J/OL]. International Journal of Chronic Obstructive Pulmonary Disease, 2019, Volume 14: 1867-1877. DOI:10.2147/COPD.S214610.
[54] MA K, LU Y, JIANG S, 等. The Relative Risk and Incidence of Immune Checkpoint Inhibitors Related Pneumonitis in Patients With Advanced Cancer: A Meta-Analysis[J/OL]. Frontiers in Pharmacology, 2018, 9: 1430. DOI:10.3389/fphar.2018.01430.
[55] RIONDINO S, ROSENFELD R, FORMICA V, 等. Effectiveness of Immunotherapy in Non-Small Cell Lung Cancer Patients with a Diagnosis of COPD: Is This a Hidden Prognosticator for Survival and a Risk Factor for Immune-Related Adverse Events?[J/OL]. Cancers, 2024, 16(7): 1251. DOI:10.3390/cancers16071251.










