盐酸伊托必利主要用于治疗肠胃疾病,进入人体之后能够抑制多巴胺D2受体乙酰胆碱,同时为抑制乙酰胆碱酶阻碍分解乙酰胆碱,通过这种方式激活肠胃活性。临床资料表明,盐酸伊托必利能够治疗消化类不良及肠胃动力障碍等疾病。此次试验发现该药物易于被人体吸收,并且药物服用之后相关物质快速增加。为保证试验结果准确性以及说服力,此次试验以盐酸伊托必利分散片与普通片作为实验对象,比较两者溶出度和稳定性。
1仪器与试药
1.1仪器
U‐2910双光束紫外可见分光光度计;RC806溶出实验仪。
1.2试药
盐酸伊托必利分散片(标示量50mg,自制,批号131202,131203,131204);普通片(标示量50mg,某制药有限公司,20131026);盐酸伊托必利对照品(食品药品检定研究院,质量分数99.9%);水为纯化水。
2方法与结果
2.1处方组成
盐酸伊托必利50mg,微晶纤维素80mg,交联聚维酮12mg,羟丙纤维素16mg,乳糖110mg,十二烷基硫酸钠0.25mg,二氧化硅5mg,硬脂酸镁1.25mg,甲基纤维素60mg,聚丙烯酸树脂Ⅳ15mg。
2.2方法学考察
2.2.1测定波长的选择
对盐酸伊托必利进行加热待完全干燥之后从中提取适量对照品,同时称取可能出现的辅料,置于试验量具中加入适量水进行溶解制备成混合溶液,通过超声方式进行过滤处理,当波长处于200-400nm时进行紫外线扫描,试验结果表明,当波长达到258nm时吸收效果最佳,而辅料在这一范围时并没有任何吸收,故此以258nm作为检测波长。
2.2.2标准曲线的建立
从对照品储备溶液中称取部分,与水混合在一起之后制备多份溶液。以水作为空白液体,当波长达到258nm时确定吸光度。测定之后证明,当盐酸伊托必利质量处于0.9375~15μg·mL-1时线性关系最佳。
2.2.3精密度实验
从“标准曲线的建立”中称取适量液体,在258nm处对其进行反复测试,参考吸光度计算RSD值约为0.03%。
2.2.4重复性实验取
从同批药品中称取一部分,将其研磨成分,精密称量倒入两句并向其中倒入水制备盐酸伊托必利溶液,于258nm波长处进行吸光度测试,计算得出RSD为0.49%。
2.2.5回收率实验
称取处方量的辅料,分别加入处方量的80%,100%和120%的盐酸伊托必利原料(即约40,50和60mg),混匀,每份质量浓度平行配制3份。按照2.3项下方法进行测定,计算回收率,结果平均回收率为99.8%,RSD为0.46%(n=9)。
2.2.6溶液稳定性实验
称取测定之后的溶液,在不同时间段测定液体吸光度,计算得出RSD值约为0.035%,试验表明8小时内药物稳定质量不会有所改变。
2.3溶出度测定
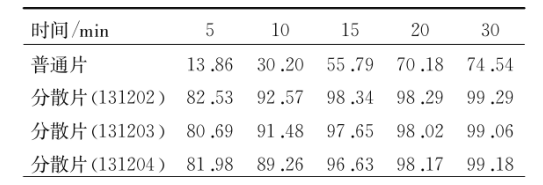
称取相同的分散片和普通药片,通过篮法以水位媒介进行溶出,将温度控制在37摄氏度,调整转速,试验开展估过程中在不同时间段进行取样,精密量取续滤液5mL,置于25mL量瓶中,加水稀释至刻度,摇匀,作为供试品溶液。在258nm波长处测定吸光度,分别计算分散片与普通片在各时间点的溶出百分率,测定结果见表1。溶出结果表明,通过在介质水中溶出曲线的对比研究,盐酸伊托必利分散片溶出行为优于普通片。
表1盐酸伊托必利分散片与普通片的累积溶出百分比
2.4稳定性考察
针对该产品对湿极不稳定的特点,按下述方法进行稳定性实验。稳定性实验包括影响因素实验、加速实验和长期留样实验。
2.4.1影响因素
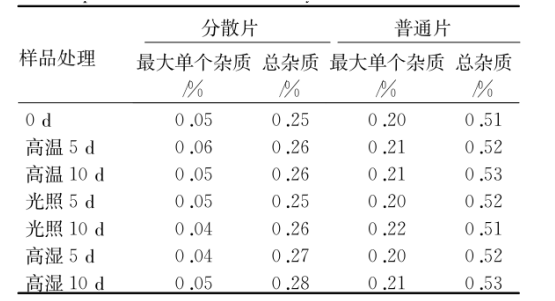
实验光照实验样品置于透明密封容器中,放在4500±500lx光照条件下实验。高温实验样品置于避光密封容器中,放在60℃条件下实验。高湿实验样品置于避光密封容器内,25℃时在RH(90%±5%)条件下实验。上述实验分别于0,5和10d取样测定有关物质。其质量对比结果见表2。结果表明,本品在高温、光照、高湿条件下均较稳定,盐酸伊托必利分散片稳定性优于普通片。
表2盐酸伊托必利分散片与普通片的影响因素实验结果
 2.4.2加速及长期留样实验
2.4.2加速及长期留样实验
加速实验将样品模拟上市包装(铝塑),在温度40℃、相对湿度75%的条件下放置6个月,分别于0,1,2,3和6个月时取样测定。长期实验将3批样品模拟上市包装(铝塑),在温度25℃、相对湿度60%的条件下放置12个月,分别于0,3,6,9和12个月时取样测定。
3讨论
当前盐酸伊托必利大多以片剂、胶囊等方式呈现,其中对药物分散片的研究略有不足。如今国内医药市场中盐酸伊托必利药物以片剂和胶囊为主,这种形式并不利于病患服用,分散片可有效解决这一问题。当药物与水接触之后会快速成为混合液体,不仅可以快速吸收,同时利用率较高,对人体影响较小。相比于比普通药片,盐酸伊托必利分散片溶出时间更短,这说明药物吸收速度更快。因药物具有亲水特性长时间处于暴露环境下回吸收空气中的水分,药物更为潮湿,药物表面粘性有所增加,致使药物溶出更为缓慢,利用率降低,稳定效果不佳;对稳定性专项试验进行分析发现,当药物处于高温、高湿等环境下,受外在条件影响相关物质优于普通药片。由上述内容可以看出,将盐酸伊托必利制备成药物分散片不仅可使自身更为稳定,同时吸收速度以及溶出度均有所提升,疗效得到保证,可在临床治疗领域推广应用。
参考文献
[1]何蕾丽.盐酸伊托必利联合氟哌噻吨美利曲辛片治疗功能性消化不良临床观察[J].临床合理用药杂志,2020,13(34):2.
[2]银沃邦,张雯珺.功能性消化不良采用盐酸伊托必利联合黛力新治疗的效果分析[J].养生保健指南2020年34期,253页,2020.
[3]李瑜斐.盐酸伊托必利联合氟哌噻吨美利曲辛片治疗功能性消化不良的临床效果[J].中国民康医学,2020,32(1):3.










