现病史:患者,女 47岁 胃癌术后3年余,规范化疗后,1年前肿瘤复发,行结肠造瘘及空肠造瘘保守治疗,因肿瘤进展,2023-4-11、2023-5-6行2周期信迪利单抗免疫治疗,2023-05-15开始出现全身皮肤黏膜及巩膜黄染,为求治疗于2023-05-17入住我院肿瘤内科。
入院查体:T:36.6℃ P:92次/分 R:22次/分 BP:90/60mmHg,神清语利,全身皮肤粘膜及巩膜黄染,未见肝掌及蜘蛛痣,心肺(-),腹部平坦,可见造瘘口及手术瘢痕,全腹无压痛、反跳痛,肝脾肋下未及,移动性浊音阴性,肠鸣音正常,双下肢有轻度可凹陷性浮肿。
既往史:否认“肝炎”、“结核”等传染病史及密切接触史。
实验室检查:血常规:WBC: 10.15*10^9/L;RBC:2.96*10^12/L;HGB:92.0g/L;PLT:178.0*10^9/L;NEU%:89.9%;LYM#: 0.34*10^9/L;
尿常规:颜色:深黄色;胆红素:+3;
粪便常规+潜血:黄色软便;潜血阴性;
生化:ALT: 558.70U/L; AST:1603.20U/L;TBIL:225.00umol/L;DBIL:210.80umol/L;IBIL:14.20umol/L;TBA:383.00umol/L;ALP:2504.00U/L;GGT: 364.00U/L;ALB:24.50g/L;
血凝:PT: 12.5 S;HD:82%,INR:1.1;DDHS: 658.0ng/ml; FDP: 4.77μg/ml;
乙肝抗原、丙肝抗体:阴性;
IgG、IgM、IgA:阴性;
影像学检查:上腹核磁平扫:1.胃Ca术后化疗后、腹部造瘘后MR表现; 肝内胆管增宽,管壁增厚、毛糙,考虑:炎性改变; 3.胆囊炎;
磁共振胰胆管水成像:1.肝内胆管增宽,管壁增厚、毛糙,考虑:炎性改变,请结合临床; 2.胆囊炎。
治疗经过:患者肝损害发生在第一次免疫抑制剂治疗后4-5周,无TCM/HDS、对乙酰氨基酚等药物大量长期使用史,结合实验室检查及影像学检查排除病毒性肝炎、自身免疫性肝炎、肝脏肿瘤转移、各种胆道梗阻等,考虑诊断:免疫介导的ICIs相关肝损伤,组织感染科、消化内科、临床药学部等行多学科会诊,依据CSCO指南:ICIs相关的的肝脏毒性管理[3],避免使用肝损伤药物,给予糖皮质激素冲击,给予降酶、退黄、保肝等药物治疗,同时给予输注白蛋白、静脉营养支持治疗,2023-5-19、2023-5-22、2023-5-25复查肝功结果示肝酶、胆红素、白蛋白等指标明显好转:肝功(2023-5-25):ALT: 80U/L; AST:23.8U/L;TBIL:63.04umol/L;DBIL:29.85umol/L;IBIL:33.19umol/L;TBA:8.55umol/L;ALP:688.42U/L;GGT: 54.4U/L;ALB:31.94g/L。
案例总结:
1. 检验案例分析
通过血、尿常规结果可以得出:该患者出现贫血并伴有炎症反应,同时怀疑存在肝胆疾病。为明确患者是否存在肝胆疾病,我们整理了患者从2023-4-11开始使用信迪利单抗+阿帕替尼治疗方案过程中肝功能指标检测值(表1)。
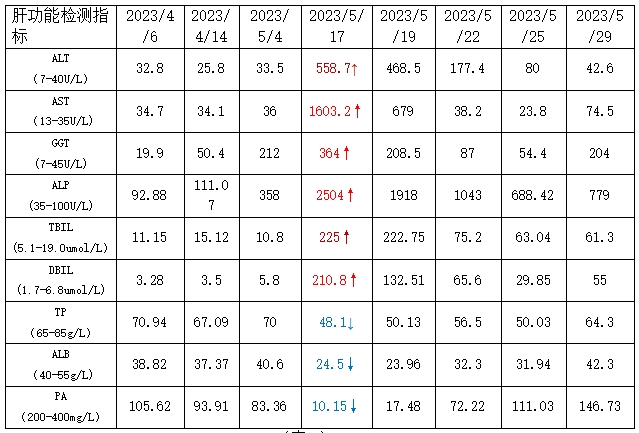 (表1)
(表1)
从表1中可以直观看出2023-5-17时ALT、AST、TBIL、DBIL、GGT、ALP出现了将近10倍左右的增高,TP、ALB、PA则出现明显的降低。通过对检测数据的初步分析,我们考虑该患者出现了肝细胞损伤坏死同时伴肝内胆汁淤积的情况。
导致这一情况的发生是否与药物使用存在一定的关系,随即我们查看并整理了患者所用药物的不良反应(表2)
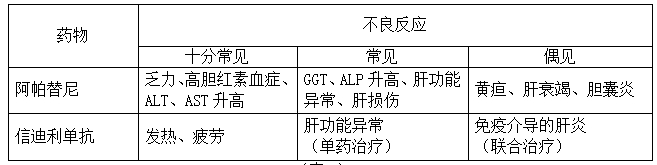 (表2)
(表2)
根据患者用药后的肝功能检测指标及药物相关不良反应,我们考虑患者出现药物性肝损伤的可能较大。以疑似 DILI 事件的首次异常肝脏生物化学检查结果计算R值, R 值= [ 丙氨酸转氨酶(ALT)实测值 /ALT 的正常值上限(ULN)] / [ 碱性磷酸酶(ALP)实测值/ALP 的ULN]。通过计算可得知R值<2 属于胆汁淤积型 [4]。
2023-5-17临床医生及时给予退黄、保肝、抗感染治疗后,各项肝功能指标有了明显改善,最终我们判断该患者在使用肿瘤药物治疗中发生了间接型 DILI。
2.临床案例分析
诊断免疫介导ICIs(免疫检查点抑制剂)相关肝损伤是本病规范治疗的前提。
本病例根据免疫检查点抑制剂用药史(第1次用药后4-5周),结合实验室检查、影像学检查排除病毒性肝炎、自身免疫性肝炎、肝脏原发肿瘤、肝转移瘤进展、各种原因引起的胆道梗阻等,且患者无TCM/HDS、对乙酰氨基酚等药物大量长期使用史,根据多学科会诊诊断ICIs相关肝脏毒性。结合化验指标患者为胆汁淤积型IMH,G4。
治疗上:根据多学科会诊意见及IMH治疗指南,永久停用ICIs治疗,给予规范激素冲击、退黄、降酶、输注白蛋白、静脉营养支持等治疗;必要时加用麦考酚酯治疗;密切监测肝功指标变化。另外,患者为胆汁淤积型IMH,G4,应给予乳果糖通便、监测血氨变化,以防氨中毒、肝性脑病等。
知识拓展:
ICIs肝毒性为免疫介导的肝损伤,属于间接型DILI范畴[5,6]。ICIs相关肝毒性通常发生在ICIs开始治疗的4-12周或1-3个周期后[7]。多数患者以ICIs肝炎为主,达到峰值时通常呈现以ALT/AST显著升高为主要表现的肝细胞损伤型[8],也有表现为胆汁淤积型和混合型。除ICIs肝炎,部分患者可呈现以胆汁淤积为主要表现的ICIs胆管炎,ALP/GGT显著升高。
治疗的关键在于根据ICIs相关肝毒性的严重程度,做出继续、暂停或永久停止ICIs治疗决策,以及是否启动糖皮质激素或免疫抑制治疗。
案例讨论:
1. 临床案例讨论
该病例为肿瘤患者应用免疫检查点抑制剂出现肝脏损害的诊断及治疗。通过详细的病史采集、规范的化验、检查、多学科会诊做出及时准确的诊断并给予规范的治疗,患者的肝损害得以明显缓解。
检验科室能够精确完成肝脏损害各种指标化验对于临床医生的诊断、评估疗效、随访有非常关键的作用。
2. 检验案例讨论
常规生化检测中肝功能指标在临床判断肝脏是否发生损伤时,可以起到早期的预警作用,但在药物性肝损伤(DILI)与自身免疫性肝炎(AIH)鉴别诊断时存在一定的局限性,则需要增添免疫球蛋白(A、G、M)及外周血自身抗体项目(ANA和ASMA滴度)等的检测。
我们临床检验工作者在日常审核报告时要密切关注指标的趋势变化,及时与临床医师进行沟通,为临床在疾病诊断中出具更加及时精准的结果。
药物性肝损伤占非病毒性肝病的20%-50%,在我国肝病中DILI的发生率仅次与病毒性肝炎及脂肪性肝病,发生率较高,但由于临床表现不特异或较隐匿,常常不能被发现或不能被确诊。该案例通过对一例DILI患者的随访及追踪体现了工作中临床科室与检验科室的多学科合作从而实现精准治疗。检验医师需提高临床知识水平,拓展临床思路,多思考异常检验结果,促进检验工作更加贴近临床实践,这将对诊断及治疗提供一定的帮助。
参考文献:
[1]中国药物性肝损伤诊治指南(2023年版)。
[2] LiX, Tang J, Mao Y. Incidence and risk factors of drug-induced liver injury[J]. Liver Int, 2022, 42(9): 1999-2014. DOI: 10.1111/liv.15262.
[3] 自身免疫性肝炎诊断和治疗指南(2021 )。
[4] 中国临床肿瘤学会(CSCO)免疫检查点抑制剂相关的毒性管理指南2022。
[5] Hoofnagle JH, Björnsson ES. Drug-Induced Liver Injury - Types andPhenotypes[J]. N Engl J Med, 2019, 381(3): 264-273. DOI: 10.1056/ NEJMra1816149.
[6] Peeraphatdit TB, Wang J, Odenwald MA, et al. Hepatotoxicity from immune checkpoint inhibitors: a systematic review and management recommendation[J].Hepatology,2020,72(1):315-329.DOI:10.1002/hep.31227.
[7] Suzman DL, Pelosof L, Rosenberg A, et al. Hepatotoxicity of immune checkpoint inhibitors: An evolving picture of risk associated with a vital class of immunotherapy agents[J]. Liver Int, 2018, 38(6):976-987. DOI: 10.1111/liv.13746.
[8] De Martin E, Michot JM, Papouin B, et al. Characterization of liver injury induced by cancer immunotherapy using immune checkpoint inhibitors[J]. J Hepatol, 2018, 68(6): 1181-1190. DOI: 10.1016/ j.jhep.2018.01.033.