药品的微生物限度检查是药品安全性检验的重要指标之一,2020年版《中国药典》(四部)中提到建立药品的微生物限度检查法所选方法的适用性须经确认。为此课题组参照《中国药典》2020年版(四部)通则1105、1106非无菌产品微生物限度检查、控制菌检查法中的标准[1],对两种复方油脂类医院制剂鼻软膏(含磺胺嘧啶、硼酸,辅料为樟脑、薄荷油、液状石蜡油、白凡士林)、鱼肝油软膏(含鱼肝油,辅料为白凡士林)的微生物限度检查方法进行优化,将较为复杂的乳化剂(5g司盘80、3g单硬脂酸甘油脂、10g聚山梨脂80)优化为十四烷酸异丙酯作为乳化剂,并进行了方法适用性验证试验,优选出适宜该两种制剂的微生物限度检查方法,确保了验证结果的可靠性及操作的简便性。
1 仪器、材料
1.1仪器
压力蒸汽灭菌器(LDZX-50KBS型,上海申安医疗器械厂)、霉菌培养箱(MJ-250-I型,上海一恒科技有限公司)、隔水式恒温培养箱(9160型,海一恒科技有限公司)、干燥箱(101-2型,中华人民共和国上海市实验仪器总厂)电热恒温水温箱(S648,上海医疗器械七厂)。
1.2样品
鼻软膏、鱼肝油软膏两种试验样品均为本院制剂室生产,每种制剂品种均取样 3个批号,每个批号取2个最小包装。
1.3试验菌株
铜绿假单胞菌181108、金黄色葡萄球菌 181025、枯草芽孢杆菌181110、黑曲霉菌181102、白色念珠菌181026、大肠埃希菌 181107。以上试验菌株含量范围500~1000cfu/颗,传代次数为4代,生产单位均为北京三药科技开发公司。
1.4培养基、稀释液及试剂
胰酪大豆胨琼脂培养基、胰酪大豆胨液体培养基、沙氏葡萄糖琼脂培养基、麦康凯琼脂培养基、麦康凯液体培养基、溴化十六烷基三甲铵琼脂培养基、甘露醇氯化钠琼脂培养基,以上培养基生产单位均为广东环凯微生物科技有限公司;0.9%氯化钠溶液(四川拜伦药业股份有限公司);十四烷酸异丙酯(广东环凯微生物科技有限公司)。
2方法
参照2020年版《中国药典》(四部)通则1105非无菌产品微生物限度检查:微生物计数法、1106控制菌检查法进行验证试验。两种制剂分别进行3次独立的平行试验,分别计算各次试验的回收比值。
2.1菌液制备
按菌株产品使用说明书:临用前用复溶液制备成每1 mL含菌数为50-100cfu的菌悬液和孢子菌液。
2.2供试液制备
鱼肝油软膏5g加乳化剂无菌十四烷酸异丙酯5ml,缓慢加入45℃的无菌氯化钠溶液至100ml,边加边搅拌,使充分乳化,得1:20供试液;鼻软膏10g加乳化剂无菌十四烷酸异丙酯10ml,加入中和剂无菌1%对氨基苯甲酸溶液10ml[2],缓慢加入45℃的无菌氯化钠溶液至100ml,边加边搅拌,使充分乳化,得1:10供试液。乳化剂和稀释剂已做对照组试验。
2.3验证试验
2.3.1需氧菌总数计数方法适用性试验:均采用平皿法,依法[3]进行3组试验,①试验组:取2.2项下制备的供试液 1mL和2.1项下制备的菌液,分别注入平皿中,倾入胰酪大豆胨琼脂培养基,每株试验菌平行制备2个平皿,按平皿法测定菌数;②菌液组:取2.1项下制备的菌液,方法同①;③供试品对照组:取2.2项下制备的供试液,方法同①。
2.3.2霉菌和酵母菌总数计数方法适用性试验:均采用平皿法,依法[4]进行3组试验,①试验组:取2.2项下制备的供试液 1mL和2.1项下制备的菌液,分别注入平皿中,倾入沙氏葡萄糖琼脂培养基,每株试验菌平行制备2个平皿,按平皿法测定菌数;②菌液组:取2.1项下制备的菌液,方法同①;③供试品对照组:取2.2项下制备的供试液,方法同①。
2.3.3计算公式:(试验组平均菌落数-供试品对照组平均菌落数)/菌液对照组平均菌落数计算回收比值。
2.3.4控制菌检查法适用性试验:依法[5]同时进行两组试验,试验组:取2.2项下制备的供试液10mL和 2.1项下制备的菌液加入增菌培养基中,根据相应控制菌检查法检查,应检出试验菌;阴性对照组不得检出试验菌。鱼肝油软膏不得检出金黄色葡萄球菌和铜绿假单孢菌;鼻软膏不得检出金黄色葡萄球菌、铜绿假单孢菌、大肠埃希菌。
3 结果
3.1计数方法适用性试验结果
3.1.1需氧菌验证回收比值
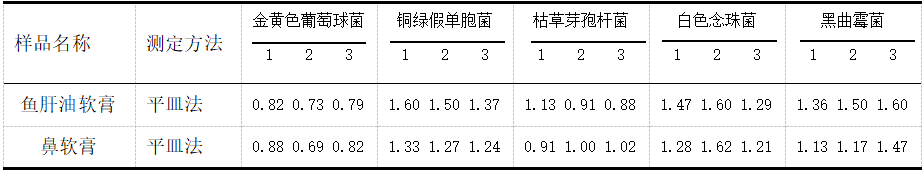
两种医院制剂的需氧菌验证回收比值结果见表1。由表1实验数据可知:需氧菌回收比值在0.5~2之间,符合药典规定。
表 1 需氧菌验证回收比值
3.1.2霉菌和酵母菌验证回收比值
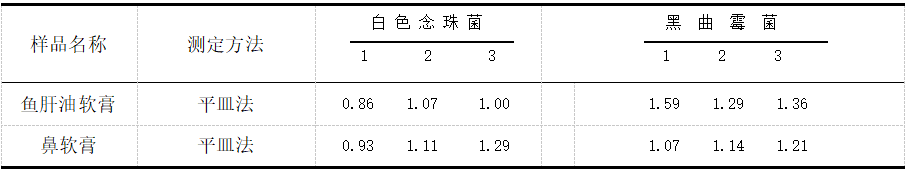
两种医院制剂霉菌和酵母菌回收比值见表2。由表2实验数据可知:霉菌和酵母菌回收比值在0.5~2范围内,符合药典规定。
表 2 霉菌和酵母菌验证回收比值
3.2控制菌检查法适用性试验结果
两种医院制剂控制菌检查验证结果见表3。由表中实验数据可知,阳性对照均检出控制菌,阴性对照组均未检出控制菌,两种医院制剂的试验组均检出了相应的控制菌。
表3 控制菌检查验证结果
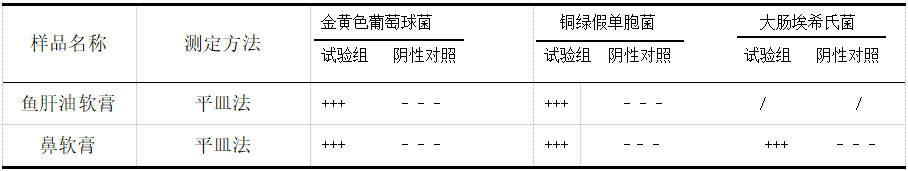
注:“+”代表控制菌被检出,“-”代表控制菌未被检出,“/”代表无需检测
4讨论
根据3.1计数方法适用性试验结果得知,需氧菌、霉菌和酵母菌回收比值均在药典规定的0.5~2的范围内,3.2控制菌检查法适用性试验结果显示控制菌均能按照药典方法检出。本课题组将两种复方油脂类医院制剂微生物限度检查方法进行优化,将原来较为复杂的乳化剂(5g司盘80、3g单硬脂酸甘油脂、10g聚山梨脂80)优化为单一的十四烷酸异丙酯作为乳化剂,优选出适宜该两种制剂的微生物限度检查方法,鱼肝油软膏采用常规平皿法,鼻软膏采用1%对氨基苯甲酸溶液中和平皿法,通过方法验证实验从而保证结果的准确性和可靠性。
参考文献:
[1] 国家药典委员会.中华人民共和国药典(四部)[S].2020年版.北京:中国医药科技出版社,2020:通则1105-1107.
[2] 韦曦,邱双成,王翠荣.29种医院制剂微生物限度检查方法验证[J].中国药房,2008,19(1):52-54.
作者简介:许盈,硕士研究生,副主任药师。研究方向:医院药学,药品检验。E-mail:34654561@qq.com



