CIN无典型临床症状,患者伴阴道炎、宫颈炎时,可能会出现接触性出血、阴道分泌物较多等症状[1]。临床根据其不典型增生程度把CIN分为三级,Ⅲ级指宫颈重度不典型增生及宫颈原位癌,为宫颈癌前期病变,对患者生活质量产生较大影响,如不引起重视甚至危及生命,所以需早期及时诊治[2]。临床常用CKC和LEEP治疗CINⅢ级患者,效果较明显,但两者的优势和缺点临床仍存在较大争议。基于此,本研究以我院收治的该类患者为例,分组对比了其选择不同手术方法的积极作用,具体报道为:
1.资料与方法
1.1临床资料
本文选择的122例研究对象是我院2019年7月至2022年3月收治的CINⅢ级患者,所有患者均经相关检查确诊,且患者症状体征均与临床相关诊断标准相符合。患者年龄平均值为(32.05±10.35)岁。根据患者病理和手术意愿分为LEEP组(60例)和CKC组(60例),
LEEP组有6例无生育史,CKC组有5例;剩余患者均有分娩史。统计学工具对比两组一般资料数据无显著差异性(P>0.05),相关指标可以参与对比。
1.2治疗方法
所有患者均选择月经结束后3~7d内进行手术,做好常规检查、化验白带等,排除手术禁忌证。指导患者把膀胱排空,保持膀胱截石位,LEEP组不用麻醉下操作,CKC组根据实际情况选择腰硬联合麻醉或全麻。对患者进行常规消毒铺巾后把窥阴器置入使宫颈充分暴露出来,再次对阴道和宫颈进行消毒,整个宫颈和穹隆部涂敷碘酊液,明确病变位置[3]。
LEEP组手术方法:按照病变程度选择适宜的电切环型号,从9点位置按照顺时针方向把病变组织及外缘环形切除3~5mm,控制其深度为15mm,对于范围比较大的病灶需分次切除,采用球形电极对创面进行电凝止血。CKC组手术方法:麻醉后协助患者保持膀胱截石位,宫颈暴露出来后,宫颈前唇用鼠齿钳牵拉进行固定,取垂体后叶素稀释液注射于宫颈后探测宫腔屈度和深度,自宫颈管口外5~10 mm位置用手术尖刀片切开一环形切口,椎尖内向宫颈内口倾斜,椎高控制为2~2.5cm,把病变组织切除后送病理,从12点位置缝合做标记。用电刀对创面进行电凝止血后缝合,手术完成后留置尿管。两组术后均静滴抗生素进行3d抗感染治疗[4-5]。
1.4观察对比指标和判断标准
(1)详细记录两组术中出血量和手术时间并进行对比;(2)术后患者可能出现切口感染、术后出血、宫颈粘连等并发症,统计计算两组并发症率;(3)对比两组术后疗效和高危型HPV持续感染率。指导患者术后1个月进行门诊复查(阴道镜及组织病理学检查、高危HPV检测、宫颈细胞学检查),前三个月每个月复查一次,之后可改为半年一次。术后3个月复查时如发现存在CIN病变者需考虑为病灶残留,超过3个月复查发现即表示复发,超过半年复查无异常表示治愈,术后半年进行一次高危型HPV检测[6]。
1.5统计学分析
研究涉及的相关数据均录入EXCEL表,用统计学工具SPSS21.0处理,用均数±标准差(`x±s)描述计量资料,先检验其分布状况,如果其与正态分布相符合,则采用LSD-t对比检验;如果其与正态分布不相符,则采用非参数比较检验。用频数或构成比描述计数资料,用卡方对比检验。P<0.05为衡量数据间差异性的标准,P<0.05表示组内组间数据存在统计学差异。
2.结果
2.1比较两组术中相关指标
对比可知,CKC组术中出血量、手术用时相对更多(P<0.05),见表1。
表1术中两组相关指标对比(`x±s)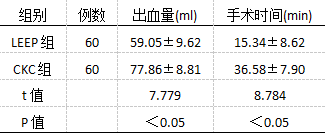 2.2比较两组术后发生并发症情况
2.2比较两组术后发生并发症情况
术后LEEP组出现5例并发症,CKC组发生2例,CKC组并发症率相对较低,但两组数据无统计学差异(P>0.05),见表2。
表2两组术后发生并发症情况对比[n(%)]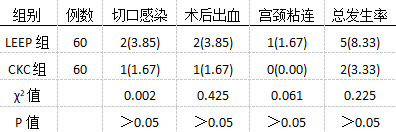 2.3比较两组锥切组织大小
2.3比较两组锥切组织大小
比较发现,CKC组锥切面积相对更小,锥高则明显高(P<0.05),见表3。
表3两组锥切组织大小对比(`x±s)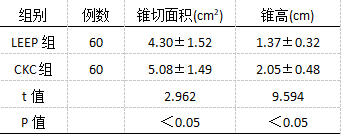 2.4比较两组术后疗效
2.4比较两组术后疗效
LEEP组有1例患者为微小浸润癌、1例切缘阳性,确定实施子宫全切术。剩余患者复查后有2例病灶残留,术后有8例患者复发,结合患者意愿和病情,其中2例再次实施LEEP术,其余均选择子宫全切术。CKC组有2例微小浸润癌、1例切缘阳性均接受子宫全切术,剩余患者未发现病灶残留,术后有2例无生育要求患者复发,沟通后确定行子宫全切术。术后两组病灶残留率无显著统计学差异(P>0.05);CKC组治愈率、复发率相对更低(P<0.05),见表4。
表4术后两组疗效对比[n(%)]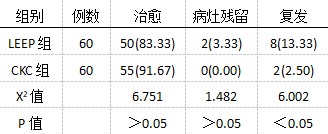 2.5比较两组术后高危型HPV持续感染率
2.5比较两组术后高危型HPV持续感染率
术后9个月,LEEP组共有6例失访,CKC组共有9例失访。术后6个月两组高危型HPV感染情况无明显差异(P>0.05);术后6个月和9个月复查,CKC组持续感染率显著更低(P<0.05),见表5。
表5术后两组高危型HPV持续感染率对比[n(%)]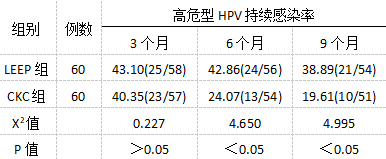 3.讨论
3.讨论
宫颈CIN病变也被称为子宫颈鳞状上皮内病变,是一组和宫颈癌关系密切的子宫颈病变,25-35岁的妇女较常发。临床按照其不典型性细胞占据上皮层的面积把宫颈CIN分为三级。CIN作为宫颈癌前病变,中国人群CINⅠ、CINⅡ、CINⅢ发病率分别占到3.1%、1.5%和1.2%。CINⅠ和CINⅡ型可能不经过CINⅢ而直接发展成浸润癌[7]。相关研究显示[8],和正常者相比,CIN患者发展为宫颈浸润癌的概率显著较高,临床当前仍未明确其发病原因,但通过研究已经确定,该病的危险因素主要有机体免疫力较低、多个性伴侣、持续感染高危型HPV病毒等。
随着当前医疗技术的快速发展,CIN及宫颈癌的检出率也逐渐提高,而且呈现出年轻化趋势,所以临床在治疗CIN时通常会选择创伤较小、具有安全性且能保留年轻女性生育功能的宫颈锥切术[9]。该类手术是一种临床常用的保守治疗术式,可较大程度避免和延缓CIN进一步发展为浸润癌,临床还常用来诊断腺上皮和宫颈鳞状上皮是否出现异常增生。手术形式主要包括:LEEP术和CKC术,LEEP术更便于操作,术中和术后出血量较少,安全性较高,因此在临床应用较广泛[10]。但是研究显示[11],部分患者实施LEEP术后病理显示切缘阳性,而且相关研究还指出,术后LEEP组发生高危HPV持续感染的情况明显多,分析可能是受CKC术病灶切除范围具有可控性影响。所以,和LEEP术相比,CKC术在减少术后复发率、病灶残留率、高危型HPV持续感染率等方面更显优势。
本文通过研究发现,和LEEP术相比CKC术中出血量、手术时间和术后发生并发症的情况均显著少(P<0.05)。研究指出,经阴道镜下活检病理证实LEEP术是诊治低级别CIN的有效措施,但LEEP电刀无法精确控制病灶切除范围,而且术中较大功率切割,极易导致标本周围出现假电热现象,所以对操作者切割水平有较高要求,避免组织切缘受到破坏而对病理诊断的精确性造成影响。研究指出[12],宫颈柱状上皮异位人群检出HPV的概率比宫颈光滑人群显著高,LEEP术和CKC术把鳞柱交界切除的同时HPV也被清除。
通过本文研究显示,CKC组持续感染高危型HPV的概率明显低,分析可能受CKC术切除病灶范围影响。相关研究还指出,和低危HPV相比,高危型HPV16病毒清除率更低,所以对于年龄相对较大,特别是术后持续感染HPV16亚型要重视定期随访。
综上所述,在女性生殖道恶性肿瘤中宫颈癌的发病率居于首位,所以临床尽早检查发现并采取有效治疗措施对提高患者生存质量有重要意义。LEEP术手术时间较短,术中出血较少,术中并发症率较低,患者容易接受,但CKC术治疗彻底性方面更显优势。所以CKC治疗需综合考虑患者的年龄和生育要求、病情、病灶范围和感染程度等,以达到最大限度清除病灶、提高患者生存质量的目的。




